|
Forscher
>
Dr. Sebastian Soukup
>
Wege zum Verständnis der Wirkung von Lebensmitteln im Menschen
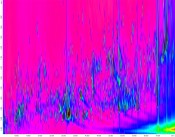
Wege zum Verständnis der Wirkung von Lebensmitteln im MenschenMetaboliten auf der Spur„An apple a day keeps the doctor away“ heißt ein oft zitiertes Sprichwort. Dabei ist es alles andere als trivial, die gesundheitliche Wirkung eines Lebensmittels wissenschaftlich zweifelsfrei nachzuweisen. Was macht dessen Wirkung aus? Geht diese auf einzelne Verbindungen zurück oder ist es vielmehr der komplexe Cocktail an Substanzen, der wirkt? Am Institut für Sicherheit und Qualität bei Obst und Gemüse des Max Rubner-Instituts beschäftigt sich die Arbeitsgruppe Metabolismus intensiv mit Metaboliten und ihren Stoffwechselwegen. Umfassende Charakterisierung des Lebensmittels als erster Schritt Wie viele und welche Verbindungen enthalten Äpfel, Trauben oder Sojabohnen, d.h. welche Verbindungen nehmen wir auf, wenn wir diese Lebensmittel oder daraus hergestellte Produkte essen? Erstaunlich, dass dies auch heute noch niemand genau weiß. Man unterscheidet zwischen den Primärmetaboliten, die Pflanzen für den Energiestoffwechsel oder andere lebensnotwendige Prozesse benötigen, und den sogenannten Sekundärmetaboliten, die häufig besonderen Aufgaben wie z.B. der Abwehr von Schadorganismen dienen. Bereits das Spektrum an Primärmetaboliten hat oft eine erhebliche Breite: Neben Glucose, Fructose und Saccharose enthält Obst und Gemüse eine Vielzahl an selteneren und teils unbekannten Mono-, Di- und Trisacchariden sowie modifizierte Zucker und zuckerähnliche Substanzen, ergänzt durch ein spezifisches Spektrum an organischen Säuren. Weiterhin kommen neben den proteinogenen oft charakteristische, nichtproteinogene Aminosäuren und andere Aminoverbindungen vor. Lipide spielen bei Obst und Gemüse quantitativ meist eine untergeordnete Rolle, dennoch zeigen beispielsweise die Spektren von Apfelschalen eine Vielzahl an diversen aliphatischen Kohlenwasserstoffen und Terpenen. Je weiter man in den Bereich der Sekundärmetaboliten vordringt, umso unüberschaubarer, aber auch einzigartiger erscheint die strukturelle Vielfalt der Verbindungen. Während Catechine und phenolische Säuren fast in allen Obst- und Gemüsesorten in recht hohen Konzentrationen vorkommen, ist das Stilbenderivat Resveratrol in roten Weintrauben und wenigen weiteren Früchten in vergleichsweise niedriger Konzentration nachweisbar. Isoflavone findet man dagegen in relevanten Mengen nur in Sojabohnen und Rotklee. Zusätzlich ist die Zusammensetzung eines pflanzlichen Lebensmittels nicht nur genetisch bedingt, sondern sie wird von weiteren Faktoren wie z.B. dem Reifegrad, den Lagerungsbedingungen und natürlich der Art der Verarbeitung deutlich beeinflusst. Die in den letzten Jahren erzielten Fortschritte bei der Verbesserung der analytischen Verfahren höhere Trennleistung und niedrigere Nachweisgrenzen bei kürzeren Analysenzeiten, gepaart mit Verfahren der bioinformatischen Datenprozessierung – ermöglichen es heute, mehrere hundert Metaboliten in einer Analyse zu bestimmen. Hierbei werden neben typischen Inhaltsstoffen auch viele bislang unbekannte Substanzen erfasst. Die Anwendung dieser sogenannten ungerichteten Analytik, auch Metabolomanalytik oder kurz Metabolomics genannt, hat in den letzten Jahren gezeigt, dass pflanzliche Lebensmittel eine erheblich komplexere Zusammensetzung haben als bisher bekannt. Zudem kann mit dieser Methode der Einfluss von endogenen wie exogenenen Faktoren auf die Zusammensetzung detailliert erfasst werden. Um diese Vielfalt an strukturell und physikochemisch sehr unterschiedlichen Verbindungen analytisch fassen zu können, sind verschiedene Verfahren wie LC-MS, GC-MS oder GC×GC-MS sowie NMR erforderlich. Am Max Rubner-Institut haben wir deshalb in den letzten Jahren eine Multi-Plattform für Metabolomics aufgebaut, die nun universell für eine umfassende Charakterisierung von Lebensmitteln (Abb.1), aber auch Biofluid-Proben wie Plasma und Urin aus Tier- und humanen Interventionsstudien zur Verfügung steht [1, 2].
Abb.1 2D-Chromatogramm der GCxGC-MS-Analyse einer Rosmarinprobe als Beispiel einer ungerichteten Metabolom-Analyse. Die Trennung auf der ersten und der zweiten Säule wird auf der x-Achse bzw. der y-Achse dargestellt. Jeder Punkt steht für einen Analyten; die Signalintensität ist farblich codiert. Nach bioinformatischer Prozessierung der Rohdaten, Prüfung der Datenqualität und Qualitätskontrolle können so pro Analyse bis zu 400 Metaboliten gleichzeitig bestimmt werden.
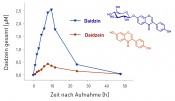
Sekundäre Pflanzenstoffe werden vom Körper als Fremdstoffe behandelt Mit der ausführlichen Charakterisierung des Spektrums an Inhaltsstoffen ist ein erster, aber wichtiger und häufig zu wenig beachteter Schritt für die Bewertung der gesundheitlichen Wirkung eines pflanzlichen Lebensmittels getan. Die zweite, nicht weniger bedeutende Aufgabe besteht nun darin, die Metabolisierung der potenziell bioaktiven Pflanzenstoffe im Menschen zu verstehen. Wie gut werden diese in den Körper aufgenommen? Werden sie von körpereigenen Enzymen und/oder Enzymen der Darmmikrobiota modifiziert? Welche der gebildeten Metaboliten sind biologisch relevant? Für die Verstoffwechselung durch körpereigene Enzyme spielen Leber und Darm die wichtigste Rolle. Dieser „Fremdstoffmetabolismus“ kann in zwei Phasen unterteilt werden. In Phase I kommt es durch enzymkatalysierte Reaktionen wie Oxidation, Reduktion oder Hydrolyse zur Bildung und/oder Freisetzung so genannter funktioneller Gruppen. Cytochrom-P450-Enzyme-katalysieren beispielsweise die Einführung von Hydroxylgruppen. In Phase II werden die Verbindungen dann durch verschiedene Transferasen in Abhängigkeit von ihrer verfügbaren funktionellen Gruppen mit aktivierter Glucuron-, Schwefel- oder Essigsäure oder mit Glutathion oder Glycin konjugiert mit dem Zweck, die Wasserlöslichkeit zu erhöhen und sie besser ausscheidbar zu machen. [3] Untersuchungen zum Metabolismus einer Verbindung beginnen häufig mit der Darstellung und Identifizierung potenzieller Metaboliten unter Nutzung von In-vitro-Modellen. Dafür werden die Substanzen meist in isolierter Form mit subzellulären Fraktionen (Mikrosomen, Cytosol) oder rekombinanten Enzymen umgesetzt und die gebildeten Metaboliten mittels NMR und/oder massenspektrometrischer Verfahren in ihrer Struktur aufgeklärt. In Inkubationen des Sojaisoflavons Daidzein mit Leber-Mikrosomen konnten wir u.a. das Oxidationsprodukt 3‘-Hydroxydaidzein identifizieren, einen Metaboliten, der aufgrund seiner Catecholgruppe potenziell über Redoxcycling reaktive Sauerstoffspezies bilden könnte [4]. Im nachfolgenden Schritt ist zu klären, wie bioverfügbar die Ausgangsverbindungen sind, welche Faktoren die Verfügbarkeit beeinflussen und welche der identifizierten Metaboliten In-vivo-Relevanz besitzen. Dafür werden biokinetische Studien zum Tier oder Menschen durchgeführt und die identifizierten Metaboliten in Blut-, Urin und Gewebeproben mittels eines gerichteten Ansatzes (targeted approach) quantitativ bestimmt. So konnten wir in humanen Interventionsstudien, die gemeinsam mit dem Institut für Physiologie und Biochemie am MRI durchgeführt wurden, zeigen, dass die Verfügbarkeit von Daidzein deutlich höher ist, wenn es wie z.B. in Sojadrinks als Zuckerkonjugat vorliegt und nicht als freies Aglykon, wie dies überwiegend in fermentierten Sojaprodukten der Fall ist (Abb.2) [5]. Im Plasma liegt Daidzein vor allem in Form seiner Phase-II-Metaboliten vor, wobei das Sulfogucuronid, ein Metabolit, der aufgrund seiner zweifachen Konjugation eher ungewöhnlich ist, mit einem Anteil von ca. 50% dominiert [6]. Der in vitro gefundene Metabolit 3‘-Hydroxydaidzein wurde dagegen in Plasma und Urin der Probanden nur in sehr geringen Mengen gefunden und hat offenbar in vivo keine Bedeutung.
Abb.2 Mittlere Plasmaspiegelkurven (n=7 Probanden) von Daidzein (gesamt; nach Spaltung der Phase-II-Konjugate) nach einmaliger Aufnahme von Daidzein und Daidzeinglucosid (1mg/kg Körpergewicht Daidzeinäquivalent). Die Verfügbarkeit des Daidzeinglucosids ist etwa um das 5-Fache höher, ebenso die maximale Plasmakonzentration [5].
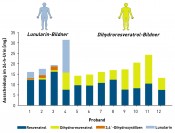
Die Metabolisierung durch die Darmmikrobiota ist hoch variabel Die körpereigenen Enzyme zur Metabolisierung von Lebensmittelinhaltsstoffen werden durch das komplexe Enzymspektrum unserer Darmmikrobiota ergänzt. Aufgrund seines hohen metabolischen Potenzials, welches das der Leber bei Weitem übersteigt, wird das intestinale Mikrobiom auch als separates Organ betrachtet [7]. Im Gegensatz zum körpereigenen Fremdstoffmetabolismus, der in der Regel hydrophilere Stoffwechselprodukte hervorbringt, führen im Rahmen der mikrobiellen Metabolisierung im anaeroben Darmmilieu vor allem reduktive und hydrolytische Reaktionen zu weniger polaren Metaboliten mit niedrigerem Molekulargewicht [8]. Sekundäre Pflanzenstoffe werden dabei vor allem dehydroxyliert, demethyliert, demethoxyliert und/oder hydrogeniert. Bei vorhandenen heterozyklischen Ringen kann es zudem zu Ringöffnungen kommen, wie im Falle des Sojaisoflavons Daidzein gezeigt [9]. Ob und wie eine Substanz durch die Darmmikrobiota verstoffwechselt wird, lässt sich auch hier mithilfe von In-vitro-Modellen (Fäzeskulturen) und In-vivo-Studien (humane Interventionsstudien) zweifelsfrei aufklären. Auf diese Weise gelang unserer Arbeitsgruppe kürzlich die Identifizierung zweier bislang unbekannter, mikrobieller trans-Resveratrol-Metaboliten [10]. Da sich die Zusammensetzung der Darmmikrobiota und somit auch das vorhandene Enzymspektrum von Mensch zu Mensch unterscheiden, können auch die entstehenden mikrobiellen Metaboliten interindividuell variieren. So weisen unsere Arbeiten zum Resveratrol beispielsweise darauf hin, dass dessen mikrobielle Verstoffwechselung bei einigen Menschen auf der Stufe des Dihydroresveratrols stehen bleibt, während in anderen Menschen noch eine Dehydroxylierung zum Lunularin stattfinden kann (Abb.3).
Abb.3 Interindividuelle Unterschiede in der Metabolisierung von trans-Resveratrol im Menschen durch die Darmmikrobiota. Weg A: Diese Gruppe Menschen bildet ausschließlich Dihydroresveratrol, das damit auch das Endprodukt der Metabolisierung ist („Dihydroresveratrol-Bildner“). Menschen der Gruppe B sind dagegen in der Lage, Dihydroresveratrol weiter zu Lunularin zu metabolisieren. Gruppe C bildet Lunularin über die Zwischenstufe des dehydroxylierten Resveratrolmetaboliten 3,4‘-Dihydroxystilben. B und C sind „Lunularin-Bildner“ [10]. Rechts: Ausscheidung von Resveratrol und mikrobiellen Metaboliten im Urin von 12 Probanden nach Aufnahme von 0,5mg trans-Resveratrol/kg Körpergewicht.
Abschließend ist der Einfluss der Metabolisierung auf die Bioaktivität der Substanz zu klären. Prinzipiell gilt, dass selbst vermeintlich kleine Veränderungen in der Molekülstruktur wie Hydrogenierungen oder Demethylierungen die biologische Aktivität entscheidend beeinflussen können. Auch Phase-II-Konjugate sind keinesfalls per se biologisch inaktiv, wie häufig angenommen wird. Bei Daidzein führt eine Glucuronidierung zwar zu Metaboliten mit deutlich geringerer Estrogenität, dies gilt aber nicht für die entsprechend sulfatierten Analoga, die eine vergleichbare oder sogar höhere estrogene Aktivität wie Daidzein besitzen können [11]. Im Fall von Resveratrol untersuchen wir in einem aktuell begonnenen DFG-Projekt in Kooperation mit Kollegen der Christian-Albrechts-Universität zu Kiel, wie relevant die neu entdeckten Metaboliten für den Menschen sind und welche Bioaktivität sie im Vergleich zu Resveratrol besitzen. Schlussbemerkung und Ausblick Mithilfe ungerichteter Metabolom-Analysen können Lebensmittel hinsichtlich ihrer Zusammensetzung zukünftig umfassender als bisher charakterisiert werden. Entsprechende Datenbanken, die hierfür nötig sind, befinden sich zurzeit im Aufbau. Zudem ermöglichen ergebnisoffene Metabolom-Analysen von Biofluiden aus Interventionsstudien, Einflüsse auf endogene Stoffwechselprozesse zu erkennen und so mögliche Wirkmechanismen aufzudecken. Ergänzend sind genaue Kenntnisse zur Biotransformation bereits identifizierter bioaktiver Lebensmittelinhaltsstoffe die Voraussetzung zum Verständnis jeder biologischen Wirkung.
Literatur Foto: © Prof. Dr. Sabine E. Kulling, istockphoto.com | gbrundin |
L&M 6 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |