|
L&M-5-2013
>
Helikal-chirale Polymere in Synthese und Analytik
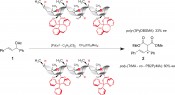
Helikal-chirale Polymere in Synthese und AnalytikMakromolekulare SchlingpflanzenEine Kurve, die sich mit konstanter Steigung um den Mantel eines Zylinders windet, wird als (zylindrische) Helix bezeichnet. Ihre Bildung kann man sich als eine Überlagerung einer Translations- mit einer Rotationsbewegung vorstellen, wobei bei gleich bleibendem Rotationssinn ein Wechsel der Translationsrichtung (Umkehr des Propagationsvektors) zur Bildung zweier Helices führt, die sich wie Bild und Spiegelbild verhalten. Es entstehen so linksgängige (M-konfigurierte) und rechtsgängige (P-konfigurierte) Schrauben, die nicht zur Deckung gebracht werden können. Nach dieser recht technisch anmutenden Einführung helikaler Objekte mag man den Eindruck haben, diese seien eher von exotischer Natur und möglicherweise nur unter entsprechenden Umständen von Interesse. Dies ist jedoch nicht der Fall. Im Gegenteil: Helikale Objekte sind auf allen Längenskalen geradezu ubiquitär (Abb. 1). Auf molekularer Ebene dienen helikale Strukturen der Strukturbildung, der Organisation der Informationsweitergabe in lebenden Systemen (doppelt-helikale Nukleinsäuren, RNA, DNA) sowie der Präsentation und räumlichen Orientierung von funktionellen Gruppen zur Realisierung komplexer chemischer Vorgänge in Organismen (etwa realisiert durch enzymatisch aktive Proteine). Es war gerade dieser letzte Punkt, der in uns 1997 den Entschluss reifen ließ, Systeme zu entwerfen, die Aufgaben dieser Art (genauer: katalytische asymmetrische Synthese) ohne Beteiligung von Biomakromolekülen übernehmen können [2]. Helikal-chirale Polymere in der Synthese Die Anwendbarkeit uniform konfigurierter, helikaler Polymere im oben genannten Sinne wird zum einen dominiert durch das Problem ihrer Herstellung und zum anderen durch die Frage ihrer konfigurativen Stabilität, also der Zeitskala, auf der das chirale Rückgrat seine stereochemische Integrität verliert. Zu Beginn unserer Arbeiten haben wir uns deshalb auf die als „statisch“ beschriebenen, sterisch überfrachteten Polymethacrylate konzentriert (Abb. 2) [3]. Nach gangselektiver anionischer Polymerisation von 3PyDBSMA (über dem Reaktionspfeil) mittels eines chiralen Initiatorsystems [5] war es möglich, Palladium zu komplexieren. Dieser polymere Pd-Komplex wiederum war ein aktiver Katalysator in der asymmetrischen allylischen Substitution mit 1 als Substrat. Das Substitutionsprodukt 2 konnte mit einem Enantiomerenüberschuss von 33 % ee isoliert werden [4]. Auch wenn diese Stereoselektion präparativ nahezu wertlos ist, so ist jedoch festzuhalten, dass dies die erste asymmetrische Katalyse ist, bei der die Stereoselektion ausschließlich eine Konsequenz der helikalen Überstruktur eines Polymers ohne stereogene Elemente in den Wiederholungseinheiten ist!
Abb. 1 Beispiele für helikale Objekte (äußerst) unterschiedlicher Größe. Von links nach rechts: Octahelicen, DNA, Schlingpflanze, Doppelhelix-Nebel [1] Später gelang es durch Anwendung des Copolymers poly-(TrMA – co – PB2PyMA; unter dem Reaktionspfeil), den ee auf 60 % zu steigern und durch Verwendung eines polymeren N-Oxides (nicht gezeigt) konnte ein organokatalytisch aktives System realisiert werden [6]. Trotz dieser Anfangserfolge haben wir uns dennoch seinerzeit entschlossen, die Polymethacrylate nicht weiter zu verfolgen, da die strukturellen Einschränkungen auf der Monomerseite und die harschen Polymerisationsbedingungen nur wenig Raum für Verbesserungen boten. In der Folgezeit erweiterten wir unseren „Polymerhorizont“ ganz erheblich.
Abb. 2 Sterisch überfrachtete Polymethacrylate als Liganden in der Palladiumkomplex-katalysierten allylischen Substitution [4] Dies bezieht sich sowohl auf die Dynamik des Polymerrückgrates und damit auf die konfigurative Stabilität des Polymers als auch auf eine Erweiterung des Spektrums möglicher Anwendungen. Mit den Polyisocyanaten wurde der Versuch gestartet, dynamisch helikal-chirale Polymere mit phosphanhaltigen Seitenketten nach dem „sergeants & soldier“-Prinzip [7] aufzubauen und als polymere Liganden für die Rhodium katalysierte asymmetrische Hydrierung einzusetzen. Dies gelang in der Tat, allerdings war die Stereoselektivität nicht zufrieden stellend [8]. Mehr über diese Anwendung und Pläne mit diesen Polymeren findet der geneigte Leser nicht nur in der zitierten Fachliteratur, sondern auch im Heft 2 (2009) dieser Zeitschrift.
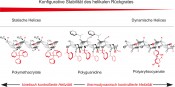
Abb. 3 Typen helikal-chiraler Polymere Helikal-chirale Polymere in der NMR-Analytik Mit den Polyguanidinen (Abb. 3), die durch Polymerisation von Carbodiimiden hergestellt werden können, haben wir ein völlig neues Anwendungsgebiet für synthetische helikal-chirale Polymere erschlossen: ihren Einsatz als Orientierungsmedium (Alignmentmedium) in der NMR-Spektroskopie. Neben der durch Bindungen vermittelten skalaren Kopplung (J-Kopplung) ist die direkte Dipol-Dipol-Wechselwirkung zwischen den Atomkernen eine für die NMR-Spektroskopie fundamentale Wechselwirkung (Abb. 4). Fasst man Kernspins im Sinne der vereinfachten klassischen Beschreibung als kleine Stabmagnete auf, so addiert oder subtrahiert sich das durch diese induzierte Magnetfeld vom statischen Feld B0. Auf diese Weise verändert sich die Resonanzfrequenz von Spin S je nach Spinorientierung (parallel oder antiparallel zu B0) von I, wodurch ein Dublett mit der Aufspaltung 2DIS für beide Spins entsteht. Die Größe dieser Aufspaltung hängt vom Abstand der Spins (rIS) und vom Winkel θ zu B0 ab (Gl. 1).
Gl. 1 In der alternativen Form der Gleichung bezeichnet r einen Einheitsvektor in Richtung der Spin-Spin-Verbindungsachse und A den Alignmenttensor.[9] Letzterer ist ein spurloser symmetrischer Tensor 2. Stufe, der die mittlere Orientierung des Moleküls beschreibt. Da in isotroper Lösung alle Orientierungen gleich wahrscheinlich sind und damitwird, verschwindet der die Mittelung der Vektororientierungen beschreibende Term in Gl. 1 und damit auch DIS. Da dies im Festkörper nicht der Fall ist, werden dort Aufspaltungen von mehreren 1000 Hz beobachtet, was zu breiten Linien unter Verlust von Verschiebungsinformation führt. Um dennoch Strukturinformation aus der dipolaren Kopplung möglichst einfach nutzen zu können, wäre es interessant, den Grad der Orientierung eines Moleküls so weit herabzusetzen, dass diese Kopplungen auf den ein- bzw. zweistelligen Hz-Bereich reduziert werden könnten (residuale dipolare Kopplungen; RDCs) [10]. In der Tat gelingt dies unter anderem durch Verwendung so genannter Alignmentmedien, etwa in Form lyotrop-flüssig-kristalliner Phasen (LLC-Phasen) [10a, 11]. Die Messung von RDCs ist, wenn man sich auf große Kopplungen über eine Bindung (1DCH oder 1DNH) beschränkt, sehr einfach. Im Prinzip eignet sich hier jedes Heterokorrelationsexperiment, das die XH-Kopplung entweder in der direkt (F2) oder indirekt (F1) detektierten Frequenzdimension enthält.
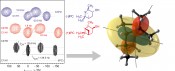
Abb. 4 Dipolare Wechselwirkung zweier Kernspins im Magnetfeld Seit einiger Zeit beschäftigen wir uns nun mit der Frage, ob helikal-chirale Polymere als Alignmentmedien eingesetzt werden können und inwieweit sie insbesondere in der Lage sind, die Enantiomeren eines chiralen Analyten unterschiedlich zu orientieren. Zur Beurteilung dieser Unterschiede dient dabei der bereits erwähnte Alignment-Tensor A bzw. das generalisierte Skalarprodukt zwischen zwei zu vergleichenden Tensoren [9].
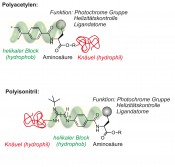
Abb. 5 Polyarylacetylene und Polyisonitrile mit optionalen Strukturmerkmalen zur Bereicherung ihres Funktionsumfanges Zu Beginn unserer Arbeiten waren lediglich einige Homopolypeptide wie etwa Poly-γ-benzyl-L/d-glutamat (PBLG/PBDG), Poly-γ-ethyl-l-glutamat (PELG/PEDG), und Poly-ε-carboxybenzoyl-l/d-lysin (PCBLL/PCBDL) bekannt, die mit Erfolg und seit langer Zeit als chirale Orientierungsmedien eingesetzt wurden [12]. Aufgrund der Tatsache, dass insbesondere kettensteife Polymere – also solche mit großen Persistenzlängen [13] – zur Ausbildung flüssigkristalliner Phasen neigen, wählten wir für unsere Untersuchungen Polyguanidine, Polyarylacetylene und Polyisonitrile aus. Alle genannten Polymere bilden LLC-Phasen, wobei insbesondere die Polyacetylene und Polyisonitrile durch ihren modularen Aufbau mit Aminosäuren in den Wiederholungseinheiten unser Interesse fanden (Abb. 5). Obwohl wir in der Tat unsere ersten Erfolge mit den Polyguanidinen (Abb. 3, Mitte) hatten [14], soll hier aus Platzgründen nur von den Polyacetylenen (PAs) die Rede sein. Diese lassen sich leicht und für eine große Anzahl von Aminosäuren mit Rhodiumkomplexen polymerisieren, wobei die absolute Konfiguration der Aminosäure die Helixgängigkeit bestimmt und erhält [15].
Abb. 6 Ausschnitt aus einem 500-MHz-CLIP-HSQC-Spektrum [17] mit Angabe der für die bezeichneten Kernpaarungen ermittelten residualen dipolaren Kopplungen. Deutlich erkennbar ist der große Unterschied dieser Kopplungen für die Enantiomeren des IPC (rote Konturlinien: (+)-IPC; blaue Konturlinien: (-)-IPC). Rechts im Bild: grafische Darstellungen des die mittlere Orientierung von (+)-IPC beschreibenden Wahrscheinlichkeitstensors (gelblich) und des Alignmenttensors (rot und grün) [18a]. Das sich von Valin ableitende System bildet ab ca. 18 % (w/w) in CDCl3 eine LLC-Phase aus, die wir für unsere Experimente mit den beiden Enantiomeren des Isopinocampheols (IPC) hergestellt haben (Abb. 6). Abbildung 6 zeigt einen Ausschnitt aus einem 500 MHz-CLIP-HSQC [17], welches CH-Korrelationen über eine Bindung anzeigt und dabei Dubletts in F2 erzeugt, die es erlauben, die effektive Kopplungskonstante 1TCH in dieser Dimension abzulesen. Aus der Beziehung 1TCH=1JCH+21DCH gewinnt man dann die gewünschten dipolaren Restkopplungen 1DCH. Diese können dann unter Verwendung eines Strukturvorschlages zur Berechnung des Alignmenttensors herangezogen werden. Auffällig sind die zum Teil außerordentlich großen Unterschiede in den RDCs einander entsprechender CH-Paare für die beiden Enantiomere des Analyten. Diese Unterschiede sind die Folge diastereomorpher Wechselwirkungen zwischen dem uniform konfigurierten polymeren Mesogen und den beiden Enantiomeren. Erwartungsgemäß sind auch die Alignmenttensoren sehr unterschiedlich, was durch die Berechnung ihres generalisierten Skalarproduktes quantifiziert werden kann [9, 18]. Diese besonders stark ausgeprägte Enantiomeren differenzierende Eigenschaft des Polyacetylens könnte die Grundlage zur Lösung des Problems der Bestimmung absoluter Konfigurationen mittels NMR-Spektroskopie bilden. Dieser „Heilige Gral“ ist in der Tat das Fernziel der DFG-Forschergruppe FOR 934, in der der Autor seit 2008 die Rolle des Sprechers einnimmt [19]. Aber es ist nicht nur die Enantiomerendifferenzierung, die diese Polymere so interessant macht. Durch die Mehrdeutigkeit der Winkelabhängigkeit der dipolaren Kopplung (Gl. 1) korrespondiert eine dipolare Restkopplung nicht mit genau einer internuklearen Vektororientierung, sondern mit einem Kontinuum von erlaubten Orientierungen [20]. Diese Mehrdeutigkeit kann aufgelöst werden, wenn RDCs in mehr als einem, möglichst orthogonal orientierenden Medium gemessen werden können. Somit ist es ein wichtiges Ziel, möglichst viele unterschiedlich orientierende Medien zu finden. Erfreulicherweise erkannten wir in der Folgezeit, dass die Orientierungseigenschaften der Polyacetylene sehr stark auf die Wahl der Aminosäureseitenkette reagieren [18b]. Im Falle eines Phenylalanin abgeleiteten Polyacetylens machten wir darüber hinausgehend die bemerkenswerte Beobachtung, dass die Orientierung stark temperaturabhängig ist (Abb. 7).
Abb. 7 Temperaturabhängigkeit der Quadrupolaufspaltung des Lösungsmittels (CDCl3) als Maß für die Anisotropie der LLC-Phase eines phenylalaninbasierten Polyacetylens [18b]. Links: (+)-IPC; rechts: (-)-IPC. Blaue Dreiecke kennzeichnen Temperaturen, bei denen RDCs gemessen wurden. Die cos b-Werte (aus dem generalisierten Skalarprodukt zweier Alignmenttensoren) [9] quantifizieren die Verschiedenheit von Orientierungen (rote und blaue Werte: gleiches Isomer, unterschiedliche Temperaturen; schwarze Werte: gleiche Temperatur, unterschiedliche Isomere). Dies gilt darüber hinaus auch noch in zweifacher Hinsicht: Nicht nur die Stärke der Orientierung, hier quantifiziert über die Quadrupolaufspaltung des Lösungsmittels (CDCl3), sondern auch die Orientierung selbst, beschrieben durch den Alignmenttensor, ist eine Funktion der Temperatur. Obendrein findet bei etwa 310 K ein Vorzeichenwechsel der Quadrupolkopplung statt, wodurch es eine Temperatur gibt, bei der man keine anisotropen NMR-Parameter mehr messen kann. Wie um den Reigen der Merkwürdigkeiten zu komplettieren, nimmt die Orientierung (Ordnung) nach diesem Punkt auch noch mit der Temperatur zu! Im Detail erkennt man drei unterschiedliche Temperaturdomänen (TD), die sich im Temperaturgradienten der Quadrupolaufspaltung unterscheiden. Innerhalb der Domänen wird der Analyt IPC gleichartig orientiert, zwischen den Domänen verschieden! Dies bedeutet, dass man mit diesem Polymer nicht nur die Stärke des Alignments variieren kann, sondern auch die Orientierung des Analyten. Es werden also gewissermaßen drei Medien durch ein Polymer realisiert. Auch die Enantiomerendifferenzierung ist abhängig von der jeweiligen Temperaturdomäne, wobei höchst bemerkenswerterweise diese in der Hochtemperaturphase besonders ausgeprägt ist. Zurzeit arbeiten wir daran zu verstehen, was hinter all diesen Phänomenen steckt und gehen dabei besonders intensiv der Frage nach der Ursache der Enantiomerendifferenzierung nach. Abschließend sei noch einmal kurz auf die präparativen Anwendungen helikal-chiraler Polymere zurückgekommen.
Abb. 8 Schematische Darstellung einer Mizelle mit chiralem Innenraum. Angedeutet ist darüber hinaus eine mögliche Fotoschaltbarkeit der Helizität. In Abbildung 5 wurden die Polyacetylene und Polyisocyanide in einer reichlich „dekorierten“ Form eingeführt. Insbesondere sollte dabei die Möglichkeit angedeutet werden, durch Kombination eines hydrophoben helikalen Abschnittes mit einem hydrophilen (rot) unstrukturierten Abschnitt amphiphile Block-Copolymere herzustellen. Da dies im Falle der Polyisonitrile bereits durch das Anbringen der hydrophilen Einheit in der Endgruppe eines Homopolymers gelingen sollte, haben wir begonnen, Systeme dieser Art zu studieren. Das Ziel dieser Bemühungen ist in Abbildung 8 illustriert. Bedingt durch den amphiphilen Charakter des Polymers sollte es möglich sein, in geeigneten polaren Lösungsmittelgemischen höher geordnete Strukturen wie etwa die dargestellte Mizelle zu erzeugen. Dabei gelangen die lipophilen helikalen, einheitlich konfigurierten Abschnitte des Polymers in den Innenraum und erzeugen so einen nanoskaligen Reaktionsraum, der im Sinne einer asymmetrischen mizellaren Katalyse [21] genutzt werden könnte. Erste ermutigende Ergebnisse dieser im Rahmen des LOEWE-Projektes „Soft Control“ geförderten Arbeiten liegen bereits vor.
Literatur |
L&M 5 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |