|
Forscher
>
Prof. Dr. Athina Zouni
>
Den Geheimnissen der Photosynthese auf der Spur
Den Geheimnissen der Photosynthese auf der SpurSolarkraftwerke en miniatureIn der Photosynthese wird Wasser in Sauerstoff und dabei Lichtenergie in chemisch nutzbare Energie umgewandelt. Die genauen Mechanismen dieser solargetriebenen Wasserspaltung sind noch unbekannt und werden derzeit mit weit entwickelten Strukturanalysetechniken untersucht. Voraussetzung hierfür sind hochwertige Kristalle des entscheidenden Proteinkomplexes, Photosystem II, deren Zucht die interdisziplinäre Forschung vor Heraus-forderungen stellt. Oft erntet man erstaunte Blicke, wenn man erzählt, dass man auf dem Gebiet der Photosynthese forscht, denn es ist ein verbreiteter Glaube, alles sei schon verstanden. Dies ist aber so nicht ganz richtig. Zugegeben, man weiß, wo die Photosynthese abläuft, z.B. in den grünen Blättern höherer Pflanzen, den wohl prominentesten Vertretern Photosynthese betreibender Organismen. Man weiß auch, dass die wesentliche lichtgetriebene Reaktion, die in den Pflanzenzellen abläuft, die Umwandlung von Kohlendioxid (CO2) und Wasser (H2O) in Kohlenhydrate (Zucker) ist. Dabei entsteht als „Nebenprodukt“ Sauerstoff (O2), der für die meisten anderen Organismen (einschließlich Menschen) für das Überleben essentiell ist. Diese Reaktion besteht aus zwei Teilen, von denen nur die eine das Licht benötigt. In dieser sogenannten Lichtreaktion wird Sonnenenergie benutzt, um Wassermoleküle zu spalten. Genauer gesagt: Dem Wassermolekül werden zwei Elektronen und zwei Protonen entrissen und auf andere Moleküle übertragen. Die dadurch in diesen Molekülen gespeicherte Energie wird dann in der separaten Dunkelreaktion für die Zuckersynthese verwendet. Was vom Wasser übrigbleibt, bildet den molekularen Sauerstoff O2. Und genau an dieser Stelle – der lichtgetriebenen Wasserspaltung – gibt es die meisten offenen Fragen, welche die Forschung auf diesem Gebiet zu einem spannenden Abenteuer machen. Zoom ins Blatt Um zu verstehen, wo die Probleme liegen, werfen wir einen genaueren Blick auf ein grünes Blatt (Abb.1). Natürlich besteht das Blatt aus Pflanzenzellen, die u.a. verschiedene Organellen enthalten, also gewissermaßen „Organe“ der Zelle, die bestimmte Aufgaben haben. Zuständig für die Photosynthese sind die Chloroplasten (von altgriechisch chlorós „grün“ und plastós „geformt“). Diese enthalten viel von dem Blattfarbstoff Chlorophyll (wörtlich „Blattgrün“, von altgriechisch phýllon „Blatt“). Die meisten Chlorophyllmoleküle – insbesondere jene, die an der Verarbeitung der Sonnenenergie beteiligt sind – sind an Proteine gebunden, die wiederum in eine komplexe Struktur aus Lipiddoppelschichten eingebettet sind, der sogenannten Thylakoidmembran (von griech. thylakos „Sack“). Uns interessiert besonders eines dieser Membranproteine, das Photosystem II (PSII), denn hier findet die Wasserspaltung statt.
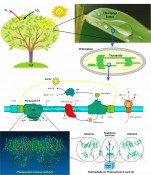
Abb.1 Zoom ins Blatt. Die Photosynthese, bei der aus Wasser (H2O) und Kohlendioxid (CO2) mithilfe von Energie aus dem Sonnenlicht (gelbe Pfeile links oben) und unter Mitwirkung des grünen Blattfarbstoffs Chlorophyll Zucker synthetisiert und Sauerstoff (O2) freigesetzt wird, läuft u.a. in den Blättern höherer Pflanzen ab. Zuständig hierfür sind in den Pflanzenzellen die Chloroplasten, die ausgedehnte Membransysteme (Thylakoide) enthalten. In und an diesen Membranen befinden sich Proteinkomplexe in einem Netzwerk unterschiedlichster Prozesse (Bildmitte. Farbcode der Pfeile: gelb, Lichtausbreitung; orangefarben, Energietransfer; blau, Elektronentransport; schwarz, chemische Reaktion; rot gepunktet, Protonentransport). Dabei sind die Photosysteme I (PSI) und II (PSII) lichtgetrieben. Mit Lichtenergie versorgt werden sie durch eigene Chlorophylle sowie durch solche, die in zusätzlichen Lichtsammelkomplexen (light-harvesting complexes, LHC) sitzen. Unten links ist die Röntgenstruktur des cyanobakteriellen PSII gezeigt, das in langen Reihen von Dimeren vorliegt [2]. Der Übersichtlichkeit halber zeigt das Bild unten rechts nur einen Ausschnitt aus der zurzeit höchst aufgelösten Struktur [1], welcher die funktionelle Unterteilung der Chlorophylle in Antennen und Reaktionszentrum verdeutlicht.
Beim PSII handelt es sich um ein Konstrukt aus zwanzig verschiedenen Proteinen und diversen daran gebundenen kleineren Molekülen (Kofaktoren). Viele davon sind Chlorophylle, die in ihrer Eigenschaft als Farbstoffmoleküle die Aufgabe haben, Licht zu absorbieren und die darin enthaltene Energie ins Zentrum des PSII zu transportieren. Dieser Transport ist extrem effektiv und die dahinter steckende Physik ein Schwerpunkt der aktuellen Photosyntheseforschung, der unter der Bezeichnung „Licht sammeln“ (engl. light-harvesting) bekannt ist. Die so eingesammelte Sonnenenergie wird im Zentrum des PSII dazu verwendet, Elektronen vom Wasser auf andere kleine Moleküle zu übertragen, nämlich Chinone, die besonders geeignet sind, zwei Elektronen und zwei Protonen aufzunehmen. Eines dieser Chinone verlässt das PSII und bringt seine wertvolle Fracht durch die Thylakoidmembran zu anderen Membranproteinen, wo es dann verarbeitet wird (Abb.1, Mitte). Die Wasserspaltung findet indes auf der anderen Seite des PSII statt. Die Aufgabe, Wasser zu spalten, ist schwieriger als man denkt. Nicht nur lässt sich das Wassermolekül nur ungern und unter hohem Energieaufwand Elektronen und Protonen entreißen. Auch muss dieser Prozess gut reguliert sein. Passt man nicht auf, entstehen giftige Moleküle als Nebenprodukte, sogenannte reactive oxygen species (ROS), die der Pflanzenzelle schaden. Diese schwierige Aufgabe wird von einem Komplex aus einem Kalzium- und vier Manganionen – im Laborjargon kurz „Mangan-Cluster“ genannt – gemeistert. Es ist durchaus nicht übertrieben, den Mangan-Cluster als den „Heiligen Gral“ der Photosyntheseforschung zu bezeichnen, denn der Mechanismus, mit dem dieser Cluster die Wassermoleküle zellschonend zerlegt, ist in weiten Teilen noch unverstanden und beschäftigt die Forscher weltweit. Voraussetzung für ein Verständnis von „Licht sammeln“ und „Wasser spalten“ ist Information über die Struktur und Anordnung der beteiligten Proteine und Moleküle. Wie gelangt man an diese Information? Wir brauchen Kristalle Um aufzuklären, wie das PSII aufgebaut ist, muss man es zunächst isolieren, d.h., so aus den Pflanzenzellen herausholen, dass es möglichst seine Fähigkeit nicht verliert, lichtinduziert Wasser zu spalten – keine leichte Aufgabe. Deshalb verwendet man hierzu keine Pflanzenzellen, sondern Cyanobakterien, entfernte Verwandte der Chloroplasten. Ihre Thylakoide enthalten praktisch den gleichen molekularen Apparat wie die der Pflanzen. Besonders geeignet sind Bakterien, die es gerne warm haben, also Thermophile wie Thermosynechococcus elongatus, die Temperaturen um 50°C bevorzugen. Die Proteine wärmeliebender Bakterien sind entsprechend stabiler, etwas leichter zu verarbeiten und man erhält ausreichende Mengen. So gelingt mit cyanobakteriellem PSII, was mit pflanzlichem PSII bislang nicht so gut funktioniert: das Züchten eines Kristalls, der Voraussetzung für die Strukturaufklärung ist. Proteine bilden normalerweise in der Natur keine Kristalle. Deshalb ist es eine Herausforderung, sie dazu zu bewegen, es doch zu tun. Dementsprechend ist die Proteinkristallisation immer noch eher eine Kunst als eine Wissenschaft und eine Sache von Versuch und Irrtum. Eine Schwierigkeit besteht bei Membranproteinen (wie dem PSII), da diese aufgrund ihrer Lage in der Zelle (z.B. in der Thylakoidmembran) nicht wasserlöslich sind. Man muss Detergenzien zusetzen, also „Seifenmoleküle“, die sich auf die membranständigen Teile der Proteinoberfläche setzen und so den gesamten Komplex wasserlöslich machen. Was diese Detergenzien während der Kristallisation des Membranproteins tun, ist unbekannt. Daher ist eines unserer Forschungsprojekte die Aufklärung der physikalisch-chemischen Mechanismen der Membranproteinkristallisation mit dem Ziel, aus der Kunst eine Wissenschaft zu machen – eine Sisyphusaufgabe. Röntgenstrahlen liefern die Struktur Hat man den Kristall, dann kann man ihn mit Röntgenstrahlen durchleuchten. Dabei erhält man allerdings nicht – wie beim Arzt – einen Schattenriss des „Knochengerüsts“ des Proteins, sondern eine Anordnung dunkler Flecken, die man mathematisch analysieren muss, um die Molekülstruktur zu rekonstruieren. Das so gewonnene Bild vom PSII ist in Abbildung 1 unten dargestellt (basierend auf [1,2]). Allein die Aufzählung und Beschreibung der vielen Komponenten des PSII würde Seiten füllen [3, 4]. Daher beschränken wir uns hier auf die Aspekte „Licht sammeln“ und „Wasser spalten“. In der Mitte des PSII befindet sich das Reaktionszentrum (RZ; Abb.1, unten rechts). Hier wird – wie oben beschrieben – die Lichtenergie benutzt, um Elektronen vom Mangan-Cluster (unten) zum terminalen Chinon (oben) zu transportieren (blauer Pfeil). Die wenigen Chlorophylle im RZ reichen aber nicht für die Versorgung mit genügend Lichtenergie aus. Sie werden von anderen Chlorophyllen unterstützt, die sowohl im PSII selbst als auch außerhalb in der sogenannten „Antenne“ sitzen. Die Antennen-Chlorophylle erhöhen die Ausbeute des absorbierten Lichts pro RZ. Allerdings muss dann ggf. ein weit vom RZ entferntes Chlorophyll die von ihm gespeicherte Lichtenergie erst zum RZ weiterleiten. Dies geschieht durch Übertragung der Energie von einem Chlorophyll zum nächsten (orangefarbene Pfeile). Dabei hängt die Geschwindigkeit dieser Übertragung von Abstand und relativer Orientierung sowie von der Proteinumgebung der beteiligten Chlorophylle ab [3, 5]. Deshalb ist eine Kenntnis der Struktur wichtig für ein Verständnis des Energietransfers. Allerdings ist beim PSII noch nicht ganz geklärt, wie der Zusammenhang zwischen Struktur und Energietransfer genau ist und auf welche Teile der Struktur es besonders ankommt. Hierfür ist noch weitere Forschungsarbeit nötig. Kürzlich ist es gelungen, eine neue Kristallform des PSII zu züchten [2]. Das Besondere daran ist die Art, wie die neue Kristallform zustande gekommen ist. Zuerst wurden Kristalle der herkömmlichen Form gezüchtet. Anschließend wurden diese durch Entzug von Wasser und Detergenz umgebaut. Ermöglicht wurde diese Vorgehensweise durch einen Wechsel des Detergenz. Auch an diesem Beispiel erkennt man die wichtige Rolle der Detergenzien in der Erforschung von Membranproteinen. Allerdings verstehen wir diese Rolle noch nicht gut genug. Das gilt auch für die natürlichen Gegenstücke zu den Detergenzien, die Lipide. Sie sind nicht nur der Stoff, aus dem die Membranen sind. Einige Lipidmoleküle sind als Kofaktoren an das PSII gebunden. Offenbar dienen sie als Kitt, der verschiedene Proteinteile zusammenhält. Die Wahl des Detergenz bei der Isolierung des PSII beeinflusst auch den Gehalt an solchen Lipid-Kofaktoren, die je nach Detergenztyp mehr oder weniger extrahiert werden. Damit wird auch der Zusammenhalt der Proteinteile verändert. In der neuen Kristallform gibt es Proteinkontakte, die bislang nicht beobachtet wurden, und tatsächlich sind an diesen Kontakten Lipide beteiligt. Ein bemerkenswerter Aspekt dieser neuen Proteinkontakte besteht darin, dass sie offenbar eine natürliche Tendenz der PSII-Komplexe widerspiegeln, sich zusammen zu lagern. Das PSII bildet nämlich im Kristall lange Reihen, die man so auch unter nativen Bedingungen in der Thylakoidmembran von Cyanobakterien findet [2]. So bildet die neue Kristallstruktur eine Grundlage für die Erforschung der Bedeutung dieser Zusammenlagerung des PSII. Wir denken, dass sie die Effizienz des Lichtsammelns erhöht. Doch kommen wir nun zum „Heiligen Gral“. Im Unterschied zum Gral aus der Sage gibt es den Mangan-Cluster nachweislich wirklich. Gesehen wurde er erstmals 2001 in der ersten Röntgenstruktur des PSII [6], war damals aber nicht viel mehr als ein formloser „Metallklumpen“. Für mehr reichte die Auflösung der Röntgenstrukturanalyse noch nicht. Ziemlich genau zehn Jahre später gelang dann einer japanischen Arbeitsgruppe der Durchbruch [1], und die in Abbildung 2 gezeigte Struktur des Mangan-Clusters wurde nachgewiesen. Dabei handelt es sich um eine Anordnung aus Metallionen (viermal Mangan und einmal Kalzium), die über Sauerstoffatome verbrückt sind. Das Gebilde erinnert entfernt an einen Stuhl, wird aber in Anlehnung an ein ähnlich würfelförmiges Molekül als Kubanstruktur bezeichnet. Dieser „Metallwürfel“ erfüllt die Aufgabe, zwei Wassermolekülen nacheinander je zwei Elektronen und zwei Protonen zu entziehen, indem er einen Zyklus aus fünf Zuständen durchläuft, die sog. S-Zustände S0, S1, …, S4 (Abb.2). Die Ziffern beziehen sich hierbei auf die Zahl der Elektronen, die der Cluster an das RZ abgegeben hat. Demnach ist er im S0-Zustand am stärksten reduziert. Der stabilste Zustand ist allerdings S1, sodass der Mangan-Cluster in diesem Zustand vorliegt, wenn das PSII sorgfältig im Dunkeln gehalten wurde. Durch gezielte Lichtblitze kann der Cluster dazu gebracht werden, den Zyklus schrittweise zu durchlaufen. Dabei bleibt jedoch der S4-Zustand hypothetisch, da er nicht auf diese Weise stabilisiert werden kann. Man nimmt an, dass zwischen S4 und S0 der Sauerstoff freigesetzt wird; genau weiß man es aber eben nicht. Hier liegt das letzte große Geheimnis der Photosynthese.
Abb.2 Mangan-Cluster und Zyklus der S-Zustände. Der Mangan-Cluster (Mn4CaO5) besteht aus einer verzerrt würfelförmigen Basis (Kuban; Mangan, metallisch blau; Kalzium, gelb; Sauerstoff, rot) und einer „Stuhllehne“ aus Mangan und Sauerstoff. Darüber hinaus sind die Metallionen an Seitenketten des Proteins gebunden (nicht gezeigt). Die hier gezeigte Struktur [1] weist noch Strahlenschäden auf, die zu Veränderungen von Atomabständen um bis zu 0,3 Ångström führen [7]. Der Mangan-Cluster bindet Wassermoleküle, die in einem Zyklus von fünf so genannten S-Zuständen gespalten werden. Durch gezieltes Belichten (gelbe Pfeile) kann der Cluster durch den Zyklus gefahren werden. Dabei werden schrittweise Elektronen (e–) an das Reaktionszentrum (vgl. Abb.1, unten rechts) und Protonen (nicht gezeigt) an das Außenmedium (vgl. Abb.1, Mitte) abgegeben. Der Zustand S4 sowie der Schritt der Sauerstofffreisetzung (O2) sind noch hypothetisch und derzeit Gegenstand intensivster Forschung.
Zum Lüften dieses Geheimnisses genügt die Röntgenstruktur leider nicht, denn sie zeigt den Mangan-Cluster nur in einem Zustand. Man könnte meinen, bei diesem Zustand müsse es sich um S1 handeln, wenn die Forscher vorsichtig genug waren, die Kristalle nicht unkontrolliert zu belichten. So einfach ist es aber nicht. Die Kristalle werden in jedem Fall der Röntgenstrahlung ausgesetzt, die immer bis zu einem gewissen Grade Strahlenschäden hervorruft. Eine Konsequenz dieser Schädigungen ist, dass Metallzentren wie der Mangan-Cluster Elektronen aufnehmen und dann nicht mehr im ursprünglichen Zustand sind. Erst im letzten Jahr konnte dieses Problem durch Anwendung einer neuen Messtechnik umgangen und die erste hochaufgelöste Struktur des PSII ohne Strahlenschäden erhalten werden [7]. Dabei wurden anstelle der üblichen Bestrahlung der Kristalle Röntgen-Pulse aus einem Freie-Elektronen-Laser verwendet, die eine Dauer von nur wenigen billiardstel Sekunden (Femtosekunden) haben. So erhält man einen Schnappschuss der Struktur, bevor die Strahlenschäden einsetzen. Auf diese Weise konnte die Kubanstruktur des Mangan-Clusters bestätigt werden, aber Atomabstände mussten immerhin um bis zu 0,3 Ångström (zehn milliardstel Meter) korrigiert werden. Damit ist nun die Struktur des S1-Zustands bekannt, d.h., man weiß, wie der „Gral“ aussieht, aber noch nicht, wie er funktioniert. Von der Struktur zur Dynamik Das ultimative Ziel ist natürlich, ein dynamisches Bild von der Wasserspaltung zu bekommen, also gewissermaßen den Mangan-Cluster bei der Arbeit zu filmen. Dies erreicht man mit einer etwas anderen Technik, bei der eine große Zahl kleiner Kristalle (Mikrokristalle) in einem Flüssigkeitsjet durch den Röntgenstrahl geschossen wird (Abb.3). Durch gezieltes Belichten des Jets können bestimmte S-Zustände eingestellt und auch die Zeitdauer zwischen Belichtung und Röntgendetektion variiert werden. Auf diese Weise konnte gezeigt werden, dass beim Übergang von S1 nach S2 und S3 keine größeren Strukturänderungen des Mangan-Clusters auftreten [8]. Derzeit wird fieberhaft daran gearbeitet, einen Schnappschuss von der eigentlichen Sauerstofffreisetzung zu erhalten. Ein Problem dabei ist, dass die Qualität der Mikrokristalle deutlich verbessert werden muss, um die Genauigkeit der Strukturen zu erhöhen. Dies führt uns zurück zu den oben geschilderten Herausforderungen der Kristallzucht. Offenbar gibt die Photosynthese ihre letzten Geheimnisse nicht so leicht preis. Deshalb ist sie auch heute noch ein aufregendes Forschungsgebiet.
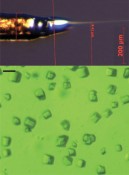
Abb.3 Mikrokristalle im Flüssigkeitsjet. Um dem Mangan-Cluster bei der Wasserspaltung röngtenkristallografisch zu filmen, schießt man Mikrokristalle des Photosystems II (unten) in einem Flüssigkeitsjet (oben) durch einen Strahl wenige Femtosekunden kurzer Röntgenpulse aus einem Freie-Elektronen-Laser. Durch gezieltes Belichten des Jets kann nicht nur der S-Zustand (vgl. Abb.2) eingestellt, sondern auch die Zeitdauer zwischen Einstellen des Zustands und Schnappschuss bestimmt werden. Auf diese Weise erhofft man sich Einsichten in den Mechanismus des Übergangs S3–>S4–>S0, wo wahrscheinlich der molekulare Sauerstoff gebildet wird. Neben der Zeitauflösung sind weitere Vorteile der Technik die physiologischen Bedingungen (d.h. Raumtemperatur) und die Vermeidung von Strahlenschäden.
Literatur
[1] Umena, Y. et al. (2011) Nature 473, 55–60 Bild: © istockphoto.com| Corina_Dragan |
L&M 2 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |