|
Chemie
 >
MOFs and more
>
MOFs and more
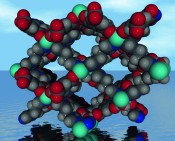
MOFs and moreMetallorganische Netzwerke (metal-organic frameworks, MOFs) haben während der letzten Jahre weltweit eine sehr große Aufmerksamkeit auf sich gezogen [1–4]. Ursache ist ihre Porosität mit einer großen Innenoberfläche sowie einstellbaren Porengrößen und -formen. MOFs sind kristalline Metall-Ligand-Verbindungen (Abb. 1) mit dreidimensionaler poröser Gitter- oder Netzwerkstruktur durch Verknüpfung der Metallatome oder Metallcluster über die organischen Brückenliganden (Abb. 2). Von MOFs werden viel versprechende Anwendungen erwartet, darunter Gasadsorption, -speicherung und -trennung von z.B. Wasserstoff, Kohlendioxid und Methan [6–9], kontrollierte und zeitverzögerte pharmazeutische Wirkstoffanlieferung im Körper [10], heterogene Katalyse [11] und in jüngerer Zeit Wassersorption für Wärmetransformationsprozesse [12,13].
Abb.1 Beispiele für MOF-Kristalle aus Lit. [5] MOFs versus bekannte poröse Materialien
Verglichen mit anderen Sorptionsmaterialien wie Aktivkohlen, Silica-Gelen oder Zeolithen können die Sorptionseigenschaften von MOFs über die organischen Liganden besser maßgeschneidert werden. Die Liganden können aufgrund der chemischen Robustheit von MOFs sogar nach erfolgter MOF-Netzwerk-Synthese noch über organisch-chemische Reaktionen (Substitutionen, Additionen) verändert werden. Dafür wurde bei MOFs der Begriff „post-synthetische Modifizierung“ geprägt [14]. Zeolithe und Silica-Gele haben vereinfacht nur die SiO4- und AlO4-Baugruppen, die über Ecken zu Netzwerken verknüpft werden. Eine Modifikation dieser Baugruppen ist nur in engen Grenzen möglich. Dagegen steht für die MOF-Liganden die Vielfalt der organischen Chemie zur Verfügung.
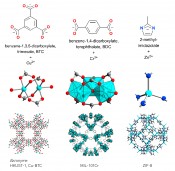
Abb.2 Typische Brückenliganden und Beispiele für „Metallknoten“ in MOFs. Die „Metallknoten“ werden als Metallcluster auch „sekundäre Baueinheiten“ genannt. Von den MOFs sind Ausschnitte aus dem Kristallgitter gezeigt. Für ZIF-8 ist die Sodalith-Käfigstruktur durch hellblaue Hilfslinien hervorgehoben. Für MOFs hat sich anstelle von wenig aussagekräftigen Summenformeln eine Nomenklatur über Akronyme eingebürgert. Die Akronyme stehen oft für die Orte der Forschungsinstitute oder für Ligandengruppen; z.B. HKUST = Hong Kong University of Science and Technology, MIL = Materials of Institute Lavoisier, ZIF = zeolitic imidazolate framework.
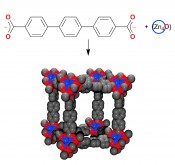
Abb.3 Terphenyl-dicarboxylat und tetranukleare Zn4-oxid-Baueinheiten von MOF-16 und Ausschnitt aus der raumerfüllenden Kristallpackung. Die Abstände zwischen den {Zn4O}-Knoten (blau) sind 21.5Å. Nicht gezeigt sind die Wasserstoffatome an den Phenylgruppen. Wasseraufnahme zur Wärmeumwandlung Ein Hindernis auf dem Weg zur breiteren Anwendung von MOFs war lange Zeit ihre nicht ausreichende hydrothermale Stabilität. Inzwischen kennt man aber MOFs, die gegenüber einem längeren Kontakt mit Wasser stabil sind und dass nicht nur aufgrund einer hohen Hydrophobie (wie bei ZIF-8). Damit hat sich für mikroporöse, wasserstabile MOFs eine mögliche Anwendung in Adsorptionskühlern und Adsorptionswärmepumpen eröffnet. Physikalische Adsorptions- und Desorptionsprozesse an inneren Oberflächen von hochporösen Materialien lassen sich für die Umwandlung von Wärme in Wärmetransformationsprozessen einsetzen [17]. Ein einfacher Aufbau veranschaulicht den Arbeitszyklus (Abb. 4), bei dem aus der Verdampfung des Wassers durch die Aufnahme in das Sorptionsmaterial Kälte entsteht, die für Kühlprozesse genutzt werden kann. Ziel ist die Entwässerung und damit die Regeneration des Sorptionsmittels mit solarthermischer Energie. Aus der Umkehrung der Wasseraufnahme und Entwässerung im Minutentakt kann so eine Klimaanlage aufgebaut werden, die aus Sonnenwärme Kälte erzeugt und daher sehr viel stromsparender arbeiten kann als herkömmliche, mit Kompressoren betriebene Klimaanlagen [13].
Abb.4 Ein einfacher Versuchsaufbau illustriert, wie die Verdampfung von Wasser nützliche Kälte erzeugt. Das Wasser verdampft nach Öffnen des Hahnes vom linken in den rechten Kolben, wo es von einem leeren, porösen Sorptionsmaterial aufgenommen wird. Rechts: Infrarotaufnahme wenige Minuten nach Öffnen des Hahns. Im Wasserkolben fällt die Temperatur auf ca. –5 °C mit Bildung von Eis; im Sorptionsmaterial steigt sie auf ca. 40 °C [12].
Bisher werden die anorganischen Materialien Silica-Gele und Zeolithe bereits in kommerziellen Adsorptionskühlern und Adsorptionswärmepumpen verwendet (Abb. 5).
Abb.5 Kommerziell erhältliche, thermisch angetriebene Kältemaschine auf Zeolith-Basis der Firma Invensor.
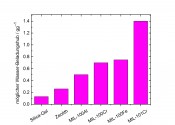
Abb.6 Vergleich von typischen Wasseraufnahmekapazitäten als Beladungshub (in g Wasser/g trockenes Sorptionsmaterial) innerhalb eines Adsorptions-Desorptionszyklus für poröse Materialien und MOFs vom MIL-Typ [21]. Die Wasserstabilität der MIL-Netzwerke wurde über eine große Zahl von Adsorptions- und Desorptionszyklen bestätigt. Weitere Untersuchungen
MOFs können mit ihrer hohen Wasseraufnahmekapazität die bisherigen anorganischen Sorptionsmaterialien für Wärmetransformationen maßgeblich erweitern. Das Wasseraufnahmeverhalten kann bei MOFs durch die hydrophile Natur des organischen Brückenliganden gesteuert werden. Auf dem Weg zur Anwendungsreife sind noch weitere Optimierungen zur Kinetik der Wassersorption und der Nachweis der hydrothermalen Stabilität für über 100.000 Ad- und Desorptionszyklen notwendig. Anstelle von Wasser sind auch Alkohole als Arbeitsflüssigkeiten möglich, womit sich das Spektrum der einsetzbaren MOFs noch erweitern lässt. Einige MOFs werden heute schon industriell hergestellt (z.B. von der BASF und unter den Namen Basolite® vertrieben). Eine aktuelle Herausforderung ist noch das Verarbeiten von MOFs zu Formkörpern und das Aufbringen von MOFs auf Oberflächen. Mit Lösung dieser Herausforderungen lassen sich Wärme- und Massentransfer noch verbessern, womit MOFs gesuchte neue Materialien für zahlreiche zukünftige Aufgaben in Wärmetransformation und -speicherung, aber auch Katalyse, Gastrennung und -speicherung sein werden.
Literatur |
L&M 3 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |