|
Die Atmosphäre
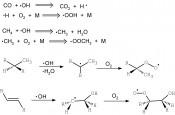
Die Atmosphäreein ChemielaborIn der Atmosphäre sind Oxidationen Schlüsselreaktionen, die eng mit den globalen Herausforderungen Klimawandel, Ozonverlust der Stratosphäre, Übersäuerung der Böden und des Wassers sowie mit den Gesundheitsaspekten der Luftqualität verbunden sind. Die Oxidation von Spurenstoffen ist dabei der eigentliche Antriebsmotor und beeinflusst sowohl die Luftqualität, das Klima als auch die Biosphäre. Aus diesem intensiv untersuchten Forschungsgebiet werden immer wieder Ergebnisse bekannt, die zu einem besseren Verständnis der physikalischen und chemischen Vorgänge in der Atmosphäre beitragen. Das OH-Radikal Die wichtigsten Oxidantien in der Erdatmosphäre sind das OH-Radikal (OH•), Ozon (O3), das Hydroperoxy-Radikal (HOO•), das Nitrat-Radikal (NO3•) und Halogenatome (Cl•, Br•, I•). OH• wird nur tagsüber (UV-Strahlung) und NO3• nur während der Nacht gebildet. Das Hydroxylradikal, das wichtigste Radikal in der Atmosphäre, entsteht bei der photolytischen Spaltung von Ozon, wobei das zunächst entstehende angeregte Sauerstoffatom mit gasförmigen Wassermolekülen reagiert. Die angeregten Sauerstoffatome können durch Stoßpartner (M; z. B. N2, O2 oder H2O), welche die überschüssige Energie aufnehmen, desaktiviert werden. Über 95 % der durch Photolyse entstandenen Sauerstoffatome reagieren wieder zu Ozon, weniger als 3 % bilden mit Wasser OH-Radikale:
O3 + hν > O• + O2 Weitere Quellen für OH-Radikale sind die Reaktion von HO2 mit NO und die Photolyse von salpetriger Säure:
HO2 + NO > •OH + NO2 Bei den durch OH• angetriebenen Reaktionsfolgen werden Sauerstoffatome auf andere Moleküle übertragen und in wasserlösliche, weiter abbaubare Hydroperoxy- oder Peroxy-Radikale überführt. Global gesehen verbraucht der Abbau organischer Verbindungen wie Isopren aus Wäldern 30 % und der Methanabbau 15 % an •OH. Wichtigster Reaktionspartner ist aber Kohlenmonoxid mit ~ 40 %. Auf diese Weise werden CO und Kohlenwasserstoffe wie Methan abgebaut (Abb. 1a), die Reaktionsprodukte kehren dann in Wasser gelöst oder als Aerosol wieder zum Erdboden zurück. OH-Radikale sind damit das wichtigste „Waschmittel“ in der Erdatmosphäre. Die durch OH• eingeleiteten Oxidationsprozesse können auch wieder zur Produktion von Ozon führen. Salpetrige Säure als •OH-Produzent Als weitere Quelle für die Bildung von OH• gilt die Photolyse von salpetriger Säure (HONO). In der unteren Atmosphäre werden bis zu 30 % der •OH-Produktion dieser Reaktion zugeschrieben. Bisher war aber nicht klar, aus welchen Quellen die dazu erforderlichen Mengen an HONO stammen. Nun konnte ein Team amerikanischer, chinesischer und deutscher Wissenschaftler diese Frage beantworten (Science 2011, 333, 1616-1618). In gedüngten Ackerböden bildet sich über biologische Prozesse aus Nitrat- und Ammoniumsalzen Nitrit, das aus sauren Böden als HONO in die Atmosphäre entweicht (Abb. 1b).
Abb. 1b: Die Verbindung von atmosphärischer HONO mit Nitrit des Erdbodens. grün: biologische Prozesse; rot: Mehrphasenprozesse zwischen gasförmiger HONO und Nitrit-Ionen; blau: andere Prozesse: gelb: heterogene Reaktionen, die NO2 und HNO3 in HONO überführen
Stickoxide können mit Abbauprodukten von Kohlenwasserstoffen zu den bekanntlich erheblich die Gesundheit gefährdenden Peroxonitraten und Nitrosaminen weiterreagieren. Endprodukt aller Stickstoffverbindungen in der Atmosphäre ist die Salpetersäure, die wie die Schwefelsäure den sauren Regen bildet. Schwefelhaltige Eintragungen Bei Vulkanausbrüchen gelangen große Mengen SO2 in die Atmosphäre (~ 2 –20 Mio. t/a). Die Eintragungen anthropogenen Ursprungs durch die Verbrennung fossiler Brennstoffe sind dagegen gewaltig – 80 – 100 Mio. t/a. Ein Teil wird mit dem Regen aus der Atmosphäre ausgewaschen, der Rest durch photochemische Reaktionen in Schwefelsäure überführt. Auch hier spielen OH-Radikale eine bedeutende Rolle:
SO2 + •OH > HSO3• Die Schwefelsäure bildet schwer flüchtige Partikel in der Atmosphäre, die als CCN (cloud condensation nuclei) dienen und als saurer Regen niedergehen. Criegee-Intermediate Wissenschaftlern war allerdings aufgefallen, dass die Bilanz •OH zu H2SO4 nicht ausgeglichen ist. Als Ursache erkannte eine Forschungsgruppe aus Finnland, Deutschland und den USA, dass eine weitere bedeutende Quelle zur Bildung von H2SO4 existiert, als sie die Atmosphäre über finnischen Wäldern unter die Lupe nahmen (M. Sipilä, R. L. Maudlin, T. Berndt et al.; Nature 2012; 488, 193-198).
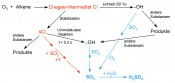
Abb. 2: Vermutlicher Mechanismus für die Bildung von Criegee-Intermediaten (CI) durch Ozonolyse. ~ 50 % zerfallen zu •OH, während der Rest in stabilisierte Criegee-Radikale (sCI) übergeht. Diese haben eine viel längere Lebenszeit und liefern •OH. Vermutlich können sCI oder Derivate SO2 oxidieren (rote Pfeile). blau: •OH-Reaktionen mit SO2
Das von ihnen zunächst als X bezeichnete Teilchen ist ebenso wie •OH in der Lage, SO2 zu H2SO4 zu oxidieren und am Abend und in der Nacht in höherer Konzentration als •OH vorhanden ist. Mit großer Wahrscheinlichkeit handelt es sich um so genannte Griegee-Intermediate, die bei der Umsetzung von Alkenen mit Ozon entstehen und dann als Oxidationsmittel für SO2 und wahrscheinlich auch andere Spurengase fungieren können (Abb. 2). Alkene wie Isopren, a-Pinen und Limonen werden aber in großen Mengen in Wäldern gebildet.
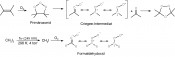
Abb. 3: Die Ozonisierung von Olefinen (oben) und die Bildung von Formaldehydoxid aus CH2I2 in der Gasphase
Bei den erstmals 1949 von Rudolf Griegee (1902-1975, Uni Karlsruhe) postulierten Intermediaten handelt es sich um Carbonyloxide, die bei der Ozonisierung von Alkenen als kurzlebige Zwischenprodukte auftreten (Abb. 3). Allerdings waren solche Teilchen bis vor Kurzem noch nicht in der Gasphase beobachtet worden. Von der Arbeitsgruppe um D. L. Osborn und C.A. Taatjes (Science 2012,335, 204-207) stammen die ersten direkten kinetischen Messungen für Formaldehydoxid, dem Produkt aus der Reaktion von •CH2I und Sauerstoff. Die Reaktion von CH2OO mit SO2 und NO2 verläuftt ungewöhnlich schnell und zeigt, dass Carbonyloxide offenbar eine größere Rolle in der troposphärischen Sulfat- und Nitratchemie spielen, als bisher angenommen wurde. Bakterien in der Troposphäre In der mittleren und oberen Troposphäre (8 –15 km) und bei den in diesen Regionen herrschenden heftigen, trockenen Winden sowie der starken UV-Strahlung überleben Bakterien und könnten das Wetter und Klima stärker beeinflussen, als man bisher dachte. Bei einem der ersten Versuche, die Mikrobiologie der Atmosphäre in größeren Höhen zu erkunden, analysierten Forscher der NASA Luftproben, die sie bei einer sechs Wochen lang andauernden Hurrikan-Kampagne etwa 10 km über dem Golf von Mexico, über der Karibischen See und über den USA gesammelt hatten (N. DeLeon-Rodriguez et al.; PNAS 2013, 110, 2575-2580). 20 % aller Partikel in den Proben bestanden aus insgesamt 314 Bakterienarten, ein höherer Anteil als in Proben der erdnahen Atmosphäre. Einige Mikroben gehören laut Genanalyse zu Bakterien, die wahrscheinlich für die Eiskristall- und Wolkenbildung verantwortlich sind. Der fundamentale Prozess der Keimbildung wird eingeleitet, wenn Wassermoleküle der Luft an einem Keim (z. B. Staub, Ruß) kondensieren. In Abhängigkeit von der Temperatur wachsen diese Komplexe zu großen Wassertropfen oder Eis. Die Befunde aus der NASA-Mission unterstützen die zurzeit von Wissenschaftlern vertretene Ansicht, dass Bakterien wesentlich das Wetter und Klima in der oberen Atmosphäre beeinflussen, zumal dort die Konzentration von Staub- und Rußpartikeln äußerst gering ist. |
L&M 3 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |