|
Forscher
>
Dr. Agnes Weiß
>
Schneller Nachweis von Krankheitserregern in Milcherzeugnissen
Schneller Nachweis von Krankheitserregern in MilcherzeugnissenFast, Faster, PhageDurch Lebensmittel übertragene bakterielle Lebensmittelintoxikationen und Lebensmittel-Toxiinfektionen sind ein weltweites Problem und verursachen massive wirtschaftliche Schäden. Wissenschaftler des Instituts für Lebensmittelwissenschaft und Biotechnologie der Universität Hohenheim und des Instituts für Lebensmittelwissenschaften, Ernährung und Gesundheit der ETH Zürich nutzen in einem gemeinsamen Forschungsprojekt Bakteriophagen, die natürlichen Feinde der Bakterien, in Kombination mit molekularbiologischen Techniken, um die gefürchteten Erreger schnell und sicher im Lebensmittel zu identifizieren. Bakteriophagen als Detektionssystem Bakteriophagen (Kurzform: Phagen) sind Viren, die ausschließlich Prokaryoten befallen. Sie wurden vor rund 100 Jahren entdeckt und stellen die größte biologische Entität auf der Erde dar. Von Anfang an wurden Phagen mit wechselndem Erfolg zu therapeutischen Zwecken eingesetzt. Sie gerieten allerdings im Westen durch die Entdeckung der Antibiotika rasch in Vergessenheit. Heute setzt man „Phagen-Cocktails“ erfolgreich zur Kontrolle von Krankheitserregern in Lebensmitteln ein [1]. Phagen sind auch verantwortlich für die großen Durchbrüche in der Molekularbiologie im letzten Jahrhundert wie etwa die Entdeckung der Restriktionsenzyme. Überdies eröffnet die spezifische Erkennung des Bakteriums durch Bakteriophagen eine Reihe von Möglichkeiten zur Entwicklung effizienter Nachweismethoden für pathogene Mikroorganismen. Bakteriophagen besitzen zwei Arten von hochspezifischen Erkennungsproteinen. Zum einen die Schwanzfasern (kurze und lange Fasern) (Abbildung 1), welche die initiale Anheftung an die Wirtszelle vermitteln und meist Zuckerreste oder Proteine in der Zellwand erkennen. Und zum anderen lytische Proteine (Endolysine), die am Ende des Infektionszyklus die Wirtszelle zerstören und ebenfalls eine hochspezifische Bindefunktion haben [2]. Endolysine lassen sich bei Gram-positiven Bakterien auch von außen zur gezielten Zerstörung von Bakterien einsetzen, bei Gram-negativen Bakterien verhindert dies die äußere Membran. Deshalb kommen hier die Schwanzfaser-Proteine zum Einsatz. Beiden Proteinen gemeinsam ist eine extrem hohe Affinität zum Zielmolekül (im picomolaren Bereich), welche Antikörpern weit überlegen ist. Der Einsatz zellwandbindender Phagenproteine für die Diagnostik von pathogenen Mikroorganismen stellt bezüglich der Sensitivität und Spezifität einen enormen Zugewinn dar.
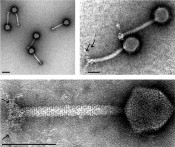
Abb.1 Elektronenmikroskopische Aufnahmen von Bakteriophagen. Die Schwanzfaser-Proteine sind (sofern sichtbar) mit Pfeilen markiert. Der Maßstab entspricht 100 nm. Krankheitserreger in Milchprodukten Bei Milch und Milcherzeugnissen spielen insbesondere Erreger wie Cronobacter spp., Salmonella enterica und der Sporenbildner Bacillus cereus eine Rolle. Auch Milcherzeugnisse wie Sahnepulver oder Molkenpulver können mit bakteriellen Krankheitserregern kontaminiert sein. Solche Produkte werden häufig als Zusatz für andere Lebensmittel eingesetzt. Ein schneller Ausschluss oder Nachweis von Erregern in diesen Produkten ist für deren Freigabe essenziell. Das Genus Cronobacter besteht aus sieben Spezies und kann lebensbedrohliche Erkrankungen wie Meningitis, nekrotisierende Enterokolitis und Sepsis bei Säuglingen und Kleinkindern verursachen. Ausbrüche sind zwar eher selten, aber in den meisten Fällen ist kontaminierte Säuglingsnahrung davon betroffen. Vertreter der Gattung Cronobacter haben die Fähigkeit, unter trockenen Bedingungen mehr als zwei Jahre zu überleben, weshalb eine Kontrolle des Keims von großer Bedeutung ist [3]. Vertreter der Spezies Salmonella enterica gehören zu den meist verbreiteten bakteriellen Erregern für Durchfallerkrankungen. Gefährdet für eine Kontamination mit Salmonella enterica sind vor allem rohe Eier, Milch und Milchprodukte. Salmonella enterica Infektionen bei Kleinkindern konnten in vielen Fällen mit kontaminierter Kleinkindernahrung in Verbindung gebracht werden [4]. Bacillus cereus ist als Erreger von Lebensmittelvergiftungen gefürchtet. Zwei Typen von Lebensmittelmittelvergiftungen können verursacht werden, das Diarrhöe-Syndrom und das emetische Syndrom. Beide Formen verlaufen meist mild und selbstlimitierend. B. cereus-Sporen sind in geringer Zahl in nahezu allen Lebensmitteln vorhanden. Insbesondere Rohmilch, pasteurisierte Milch und Milchpulver sind in Ausbrüche verwickelt. Eine hohe Belastung weist dabei aber Säuglingsnahrung auf [5]. Das Auftreten von Krankheitserregern in Lebensmittelprodukten hat eine hohe wirtschaftliche Bedeutung, da es immer wieder zu teuren, imageschädigenden Rückrufaktionen kommen kann. Gerade für kleine und mittlere Unternehmen können solche Vorfälle schnell existenzbedrohend werden. Der zuverlässige Nachweis dieser Bakterien in Lebensmitteln nach Standardmethoden dauert zwischen vier und sechs Tagen. Insbesondere für Produkte mit kurzer Haltbarkeit ist diese lange Zeitspanne problematisch. Eine Verkürzung der Nachweismethoden ist daher aus Verbraucher- und Produktsicherheitsgründen anzustreben.
Abb.2 Mit Phagenprotein beschichtete paramagnetische Nanopartikel binden Zellen von Salmonella enterica. Stand der Forschung – Nachweisverfahren im Überblick Konventionelle Nachweisverfahren für Salmonella enterica, Cronobacter spp. und Bacillus cereus bestehen im Regelfall aus einer Voranreicherung, gefolgt von einer selektiven Anreicherung in speziellen flüssigen Nährmedien, der anschließenden Bestätigung auf festen Selektivmedien sowie biochemischen Tests für die endgültige Identifizierung der Organismen (Abb. 3). Für Salmonella enterica wird das amtliche Verfahren nach § 64 Lebensmittel- und Futtermittelgesetzbuch (LFGB) (L 00.00-20, 2004-12) angewendet. Die Untersuchung auf Cronobacter spp. mit kulturtechnischen Methoden erfolgt derzeit nach ISO/TS 22964 IDF/RM 210:2006, welche bis zur Verdachtsdiagnose mindestens drei Tage, bis zur Speziesidentifikation fünf bis sechs Tage erfordert. Diese Methode stellt zwar ein offizielles Nachweisverfahren für die Industrie dar, jedoch steht eine Optimierung noch aus. Auch für B. cereus stehen erprobte Standardverfahren zum kulturellen Nachweis zur Verfügung (amtliche Sammlung § 35 LFGB, L 01.00-53: 1992, L 00.00-72:2000), dennoch fehlen generell alternative Methoden zum Schnellnachweis und zur Risikoabschätzung. Modernere Methoden kombinieren zur Zeitersparnis kulturelle Verfahren mit einem PCR-Nachweis. Obwohl der alleinige Einsatz von molekularbiologischen Methoden zwar einen schnelleren Nachweis der Organismen ermöglicht als kulturbasierte Methoden, können diese Methoden nur als Indizienbeweise gelten und nicht zwischen lebenden und toten Organismen differenzieren. Außerdem benötigen sie ebenfalls zeitaufwändige Anreicherungsschritte, da die Nachweisgrenze durch die schwierige Matrix leider oft relativ hoch liegt. Die lange Zeitspanne bis zum sicheren Nachweis der Erreger bedeutet einen erheblichen ökonomischen und wirtschaftlichen Verlust, da sich entweder die Lagerzeit der Produkte bis zum Weiterverkauf verlängert oder es sogar zum Rückruf des entsprechenden Lebensmittels kommen kann. Eine schnellere und sichere Nachweismethode kann hier einen wesentlichen Anteil zur Lebensmittelsicherheit und der Minimierung wirtschaftlicher Verluste beitragen. Das Forschungsziel dieses Kooperationsprojekts liegt deshalb in der Entwicklung eines modernen molekularbiologischen Nachweisverfahrens, welches innerhalb von 24 Stunden eine Diagnose über das Vorhandensein des Keimes im Lebensmittel liefert. Die Forschungsarbeiten werden im Rahmen des vom Forschungskreis Ernährungsindustrie (FEI) geförderten Projekts „Optimierung von Nachweis und Differenzierung von Salmonella enterica, Cronobacter sakazakii und Bacillus cereus in Milch und Milcherzeugnissen durch den Einsatz von zellwandbindenden Phagenproteinen“ (AiF 16756 N) durchgeführt.
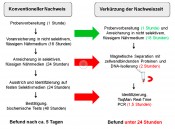
Abb.3 Schema des konventionellen Nachweisverfahrens und der Verkürzung der Nachweiszeit von bakteriellen Krankheitserregern in Milch und Milcherzeugnissen. Wege zu einem sicheren Lebensmittel – molekularbiologisches Nachweisverfahren Durch die Zusammenarbeit der beiden Forschungsgruppen wird ein verbessertes Nachweissystem für pathogene Bakterien in Milchprodukten entwickelt. Die Methode kombiniert eine kulturelle Anreicherung, den Einsatz von hochspezifischen Bindeproteinen eines Bakteriophagen und einen Nachweis mittels Real-Time PCR. Die Nachweiszeit kann dadurch auf unter 24 Stunden verkürzt werden (Abbildung 3). Phagen(-proteine) erkennen Bakterien speziesspezifisch, teilweise sogar stammspezifisch. Bei der Suche nach geeigneten Proteinen werden ausschließlich Phagen mit einem breiten Wirtsspektrum benutzt, da die verwendeten Proteine nach Möglichkeit alle repräsentativen Vertreter der Zielgattung binden sollen. Die Bindeproteine aus verschiedenen geeigneten Phagen können recht einfach rekombinant in E. coli produziert werden. Sie werden mittels eines angehängten Biotin-Moleküls gerichtet und irreversibel an streptavidinbeschichtete Nanopartikel gebunden. Die Partikel binden ein bis mehrere Bakterien (Abb. 2) und lassen sich sehr einfach mithilfe eines Magneten konzentrieren und immobilisieren. Die Probe kann nach einigen Waschschritten sowie nach der Entfernung des Magneten direkt für den Nachweis eingesetzt werden. Die Identifikation erfolgt mittels spezifischer TaqMan Real-Time PCR. Um falsch positive Ergebnisse sicher ausschließen zu können, wird eine interne Amplifikationskontrolle verwendet. Dieses Verfahren lässt sich bei Milchpulvern mit einem geringen aW-Wert (0,20) und dehydrierten Bakterien erfolgreich einsetzten. Dabei spielt auch der Nachweis von geringen Bakterienkonzentrationen eine große Rolle. Die vorhandenen, noch lebenden Bakterien sind aufgrund der Trockenheit gestresst und weisen zunächst ein stark verlangsamtes Wachstum auf. Daher muss für den Nachweis eine längere Anreicherungszeit garantiert sein. Nur dann ist eine „Erholung“ der Bakterien möglich und ein sicherer Nachweis gewährleistet. Durch eine künstliche Kontamination von Säuglingsnahrung mit C. sakazakii kann der Nachweis von 0,01 Kolonien-bildenden Einheiten (KbE) gestresster Bakterienzellen mithilfe der entwickelten Real-Time PCR-Methode demonstriert werden. Die Spezifität der neuen Methode wird also durch zwei Mechanismen sichergestellt. Zum einen binden Phagenproteine hochspezifisch nur an die gesuchten Bakterien, Kreuzreaktionen über Artgrenzen hinweg kommen kaum vor. Zum anderen wird im Assay ein spezifischer und schneller Nachweis der Bakterien mittels TaqMan Real-Time PCR nachgeschaltet. Des Weiteren werden die zeitaufwändigen Anreicherungsschritte massiv verkürzt. Potenzial für die Diagnostik Das im Rahmen des Kooperationsprojekts entwickelte Nachweissystem bietet große Vorteile gegenüber den etablierten Systemen. Die Anreicherung mithilfe beschichteter Nanopartikel kann 99?% der Bakterien aus einer beliebigen Probe unter verschiedensten pH-Werten und Salzkonzentrationen und trotz des Vorhandenseins einer Begleitmikrobiota aus nahe verwandten Keimen sicher nachweisen. Der Nachweis von 0,01?KbE gestressten Bakterien ist mittels des nachgeschalteten PCR-Assays möglich. Die Methode ist schnell, zielführend und spezifisch. Für die Umsetzung im industriellen Labor muss außer einem Real-Time-PCR-Gerät (welches oft bereits vorhanden ist) kein zusätzliches Gerät angeschafft werden. Die Durchführung erfordert kein speziell ausgebildetes Personal und die Komponenten des Detektionssystems können kostengünstig in entsprechenden Mengen hergestellt werden. Diese sind bei geeigneter Lagerung im Kühlschrank Wochen oder Monate haltbar. Mit dieser Methode lassen sich leicht verderbliche Lebensmittel auf pathogene Bakterien untersuchen, bevor sie in den Handel gelangen. Das Nachweissystem ist außerdem relativ einfach erweiterbar, um auch für die Detektion von anderen Bakterienarten eingesetzt werden zu können. Die bisher entwickelte Methodik übertrifft bereits in Teilen die gesetzlichen Vorgaben bezüglich der Nachweisgrenze für den Nachweis von pathogenen bakteriellen Keimen im Lebensmittel. So ist es beispielsweise möglich, eine einzelne KbE von Salmonella aus 1?ml Lebensmittel mit 99?%iger Wahrscheinlichkeit zu detektieren. Damit eignet sich das Verfahren grundsätzlich zum Einsatz in der industriellen Diagnostik.
Literatur Foto: © panthermedia | Sebastian Kaulitzki |
L&M 1 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |