|
L&M-8-2014
>
Die kritische Rolle der Fettsäureverteilung zwischen Membran- und Speicherlipiden
Die kritische Rolle der Fettsäureverteilung zwischen Membran- und SpeicherlipidenWenn der Fettstoffwechsel kipptSie sind so dünn wie die Hülle einer Seifenblase – und trotzdem von lebenswichtiger Bedeutung. Biologische Membranen, 10.000-mal dünner als ein menschliches Haar, bilden die physiologische Barriere aller Zellen und sind somit für einen geregelten Austausch zwischen Innen- und Außenwelt unserer Körperzellen verantwortlich. Geringfügige Veränderungen ihrer Zusammensetzung, z.B. bei Fettstoffwechsel- störungen, können fatale Auswirkungen auf das zelluläre Geschehen und somit schwerwiegende Erkrankungen zur Folge haben. Membranfette – Speicherfette: eine enge physiologische Beziehung Das Grundgerüst aller Membranen ist aus einer enorm komplexen Mischung verschiedener Fettstoffe (Lipide; von griechisch lipos=Fett) aufgebaut, von denen das Cholesterin oder auch das Lecithin allgemein bekannte Vertreter sind. Biologische Membranen grenzen die Zelle gegen die Umwelt ab und stellen somit sicher, dass das zelluläre Milieu – auch bei sich ändernden Umweltbedingungen – konstant bleibt. Darüber hinaus sind in höher entwickelten Zellen zahlreiche Organellen mit spezifischen Funktionen innerhalb der Zelle von Membranen umgeben: So hält im Zellkern eine Doppelmembran die genetische Information in Form der DNA vom Cytosol getrennt; die „Kraftwerke“ der Zellen, die Mitochondrien, sind ebenfalls von einer Doppelmembran umgeben. Andere Organellen wie z.B. das endoplasmatische Retikulum oder Peroxisomen besitzen ebenfalls eine Membran. Diese intrazelluläre Kompartimentierung stellt sicher, dass auf- und abbauende Stoffwechselwege in präzise geregelter Weise nebeneinander – von Membranen getrennt – ablaufen können. Neben den membranbildenden Lipiden sind es vor allem die in diese Membranen eingebetteten Proteine, die spezifische Funktionen ausüben und deren Aktivität stark von der Lipidzusammensetzung der Membran geprägt ist. Zu diesen Funktionen zählen (selektiver) Stofftransport durch die Membran, Signalfunktionen und zahlreiche biochemische Reaktionen, die von Enzymen in der Membran katalysiert werden.
Im Gegensatz zu den Membran-Lipiden dienen Speicherfette, die sich bisweilen unangenehm am Bauch und an den Hüften bemerkbar machen, vorwiegend als Energiereserve, wenn andere Ressourcen wie z.B. Zucker erschöpft sind. Besonders Muskeln sind zur Energiegewinnung auf die Verbrennung von Fettsäuren, die aus Speicherfetten mobilisiert werden, angewiesen. Eine weitere wichtige Funktion von Speicherfetten besteht darin einen potenziellen Überschuss an (freien) Fettsäuren abzupuffern, um eine toxische Belastung der Zelle zu vermeiden. Diese fettsäureinduzierte „Lipotoxizität“ wird als Ursache von lipidassoziierten Erkrankungen wie z.B. metabolisches Syndrom, Fettleibigkeit oder Diabetes mellitus Typ 2 diskutiert [1]. Auch die Entstehung von Krebs wird zunehmend mit Störungen des Fettstoffwechsels in Zusammenhang gebracht. Die Erforschung der Ursachen lipotoxischer Veränderungen ist daher auch Ziel weltweiter Forschungsaktivitäten, um die grundlegenden Mechanismen besser zu verstehen, welche die Regulation der Fettsäureaufnahme und ihren Stoffwechsel steuern (siehe dazu auch: Spezialforschungsbereich LIPOTOX http:/
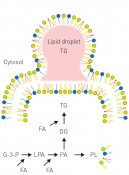
Abb.1 Unten: Die Bildung von Triglyceriden (TG) und Membranphospholipiden läuft über dieselben Vorstufen lyso-Phosphatidsäure (LPA) und Phosphatidsäure (PA). Abhängig von der Verfügbarkeit von Fettsäuren (FA) wird mehr oder weniger Triglycerid gebildet, während die Menge an Membranphospholipiden (PL) konstant gehalten wird. Ist die Biosynthese von TG gestört, führt ein Überangebot von Fettsäuren zu Veränderungen der Membranlipide und damit zu einer Fehlfunktion der Membranen und zum Zelltod. G-3-P: Glycerol-3-Phosphat; LPA: lyso-Phosphatidsäure; PA: Phosphatidsäure; DG: Diglycerid; TG: Triglycerid; PL: Phospholipid, FA: Fettsäure.
Oben: Triglyceride (TG) werden in sogenannten Fetttröpfchen („lipid droplets“ (LD)) gespeichert. Der Mechanismus der Biogenese von LDs ist umstritten; das derzeitige Modell geht davon aus, dass TG zwischen den Membranhälften akkumulieren und LDs nach Erreichen einer entsprechenden Größe in das Cytosol abknospen.
Membranbildende Lipide und Speicherlipide werden aus gemeinsamen Vorstufen, u.a. Fettsäuren, aufgebaut, die z.B. aus der Nahrung stammen (Stichwort gesättigte Fettsäuren, trans-Fettsäuren, Omega-3-Fettsäuren) oder bei Bedarf zum Teil auch von den Körperzellen selbst gebildet werden. Diese Verwendung gemeinsamer Vorstufen (Abb.1) erfordert somit eine ausgeklügelte zelluläre Regulation, um sicherzustellen, dass Membranlipide in der richtigen qualitativen und quantitativen Zusammensetzung gebildet werden [2]. Dies ist insbesondere für das zelluläre Wachstum von entscheidender Bedeutung, da bei jeder Zellverdopplung auch die zellulären Membranen entsprechend verdoppelt werden müssen. Es konnte bereits klar gezeigt werden, dass eine fehlerhafte Synthese von Speicherfetten zu einer dramatischen Sensitivität der Zellen gegenüber Fettsäurebelastung führt [3]. Andererseits führt ein fehlerhafter Abbau von Speicherfetten zu negativen Auswirkungen auf das Zellwachstum, da die Membranlipidsynthese beeinträchtigt ist [4]. Hefe, metabolisches Syndrom und Krebs – ein veritables experimentelles System zur Erforschung von Kulturkrankheiten Die enorme Komplexität und die Beteiligung verschiedenster Organe und Zelltypen am Fettstoffwechsel ist eine besondere Herausforderung an die biomedizinische Forschung. In der Forschung bedient man sich daher einfacherer Modellsysteme wie z.B. der Fruchtfliege, des Fadenwurms oder verschiedener einzelliger Pilze („Hefe“), die experimentell wesentlich vielfältiger, aber deutlich einfacher und überdies ethisch unbedenklich zu handhaben sind. Neben den bekannten technologischen Anwendungen von Hefe (Germ) in der Bier-, Wein- und Brotherstellung und in den letzten Jahren auch in der Treibstoffindustrie (Bioethanol) ist dieser Organismus als hervorragendes Modellsystem für die zelluläre Grundlagenforschung etabliert [5]. So gehen z.B. in den vergangenen Jahren zahlreiche Nobelpreise auf das Konto von Hefe-Forscherinnen und -Forschern für ihre grundlegenden biologischen Erkenntnisse, die auch für menschliche Zellen Gültigkeit besitzen (2001: Lee Hartwell, Paul Nurse – Zellzyklus; 2006 Roger Kornberg – Transkription; 2009: Elizabeth Blackburn, Carol Greider, Jack Szostak – Telomere; 2013: Randy Schekman – Vesikeltransport). Darüber hinaus wird Hefe in der Altersforschung und zur Aufklärung neurodegenerativer Erkrankungen erfolgreich eingesetzt. Etwa ein Drittel der insgesamt 6.000 Hefegene hat ein Pendent im humanen Genom und ca. 20% der mit genetisch bedingten Krankheiten im Menschen in Verbindung stehenden Gene haben ein Homolog in der Hefe. Neu entwickelte Pharmaka werden routinemäßig an Hefezellen getestet, was die Identifizierung der molekularen Targets erleichtert. Weiterhin steht ein enorm vielfältiges Repertoire an Technologien zur Verfügung, um nicht nur Einzelfaktoren zu untersuchen, sondern die Zelle in der Gesamtheit ihrer physiologischen Prozesse systematisch zu studieren. Die Zellen sind im Labor durch die kurze Verdopplungszeit von nur 90 min einfach und in großen Mengen zu kultivieren und biochemisch und genetisch manipulierbar. Diese kurze Verdopplungszeit ist überaus erstaunlich, da die Zellen über einen sehr komplexen Aufbau verfügen, der dem von menschlichen Zellen ähnelt: Neben dem membranumschlossenen Zellkern besitzt die Hefe Mitochondrien, das vielfältig verzweigte Membransystem des endoplasmatischen Retikulums, Vesikel, Vakuolen und – zur physiologischen Abgrenzung nach außen – eine Plasmamembran (Abb.2). Ähnlich wie auch in tierischen und pflanzlichen Zellen gibt es die Fetttröpfchen, die für die Fettspeicherung verantwortlich sind (Abb.3).
Abb.2 Subzelluläre Organellen von Hefe. Die jeweiligen Membranen werden durch Färbung mit spezifischen Farbstoffen unter dem Fluoreszenzmikroskop sichtbar gemacht. Die Zellgröße beträgt 5-7 µm. Von links nach rechts, obere Reihe: Vakuolen, endoplasmatisches Retikulum, Mitochondrien. Untere Reihe: Zellkern, Lipidtröpfchen, Plasmamembran.
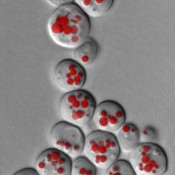
Abb.3 Fluoreszenzmikroskopische Aufnahme von lipid droplets (LD) in Hefezellen. LDs werden mit speziellen Fluoreszenzfarbstoffen angefärbt und können dadurch im Mikroskop sichtbar gemacht werden. Zahl und Größe der LDs geben Auskunft über mögliche Störungen im Speicherfettstoffwechsel. In diesem Hefestamm fehlen die beiden wichtigsten Lipasen, die für den Abbau der Triglyceride verantwortlich sind.
Hefe und humane Krebszellen ähneln einander insbesondere in Bezug auf den Fettstoffwechsel [6], was den Modellcharakter des Hefesystems unterstreicht. Auch das Hauptenzym des menschlichen Fettabbaus – die Adipose Triglyceridlipase ATGL – hat ein Pendant in der Hefe [7]. Wird die Fettspaltung in der Hefe gestört, entwickeln sich „fettleibige“ Hefezellen, die den Überschuss an Speicherfett (TG) in Fetttröpfchen deponieren (Abb.3). Der Abbau von Speicherfett ist notwendig, um Vorstufen für die Synthese von Membranlipiden während des Zellwachstums zu liefern: Fehlen die für den Abbau verantwortlichen Enzyme, sind die Zellen nicht nur fett, sondern sie zeigen eine deutliche Verzögerung bei der Zellteilung. Derzeit wird intensiv an den Regelfaktoren des Zellzyklusprogramms geforscht, die auf die veränderte Lipidmobilisierung reagieren [8]. Fehlt den Zellen die Möglichkeit, Fett aufzubauen, z.B. durch die Inaktivierung der für die Fettsynthese benötigten Gene in entsprechenden Mutanten, reagieren die Zellen extrem sensitiv auf ein erhöhtes Fettsäureangebot und sterben sehr rasch ab, da das Membrangleichgewicht empfindlich gestört wird. Dies unterstreicht die Bedeutung von Speicherfett als „Puffer“, um einen Überschuss von Fettsäuren, die z.B. durch die Nahrung aufgenommen werden, abzufangen und für den Organismus unschädlich zu machen. Eine fehlerhafte Fettsäureentgiftung könnte die Ursache für die Schädigung der für die Insulinproduktion zuständigen b-Zellen in der Bauchspeicheldrüse sein und zur Entstehung von Diabetes Typ 2 bei fettleibigen Patientinnen und Patienten beitragen. Lipidtröpfchen – das unbekannte Organell Bis vor wenigen Jahren herrschte die Meinung vor, dass Speicherfett in Form von inerten Fetttropfen in der Zelle abgelagert wird. Tatsächlich handelt es sich um ein hoch kompliziertes Organell: Lipidtröpfchen (lipid droplets, LDs) sind in der Zelle von einer Membranlipidschicht umhüllt (Abb.1) und an der Oberfläche mit einer Vielzahl an Proteinen dekoriert [9]. Diese Proteine dienen dem Auf- bzw. Abbau von Speicherfetten bzw. der Regulation dieser Prozesse und spielen eine wichtige Funktion bei der Interaktion mit anderen Organellen wie z.?B. den Mitochondrien. Bei Spaltung von Speicherfetten werden die freigesetzten Fettsäuren etwa in den Mitochondrien zur Energiegewinnung „verbrannt“. In Tieren und im Menschen werden die aus dem Fettgewebe freigesetzten Fettsäuren über die Blutbahn zum Herz- und Muskelgewebe oder zur Leber transportiert und dort verbrannt bzw. wieder in Speicherfett umgewandelt. Nach dem derzeit diskutierten Modell wird Triglycerid in der Membran des endoplasmatischen Retikulums synthetisiert und zwischen beiden Membranhälften eingelagert; nach Erreichen einer gewissen Größe wird das entstehende LD in das Cytosol abgeknospt. Aus diesem Modell lässt sich die Oberflächenstruktur der LDs erklären, die von einer Phospholipid-Monoschicht umgeben sind – im Gegensatz zu allen anderen Organellen, die eine Doppelschicht aufweisen (siehe Abb.1). Hunderte verschiedene Proteine konnten bisher identifiziert werden, die mit Lipidtröpfchen assoziiert sind und eine mögliche Rolle bei der Biogenese dieser Organellen oder bei der Fettspeicherung und -mobilisierung spielen. Obwohl die Biogenese der Lipidtröpfchen eine zentrale Rolle bei der Fettspeicherung spielt, sind jedoch wesentliche Fragen noch ungeklärt: Ist das vorherrschende Modell, also die TG-Speicherung zwischen den Membranhälften, korrekt? Wann und wie erfolgt die Abknospung? Wie gelangen LD-assoziierte Proteine auf das Organell und wie werden diese Prozesse reguliert? Wie wird die Synthese von Membranlipiden und Speicherlipiden reguliert? Die enge physiologische Wechselbeziehung zwischen Membranphospholipiden und Triglycerid-Speicherung und -Mobilisierung und die damit in Zusammenhang stehenden Störungen werden vielfach als Grundlage unserer sogenannten „Kulturkrankheiten“ angesehen und weltweit intensiv erforscht. Man kann davon ausgehen, dass die Forschungen an Hefe auch in Zukunft wesentliche Beiträge zu unserem Verständnis der Lipidhomöostase in menschlichen Zellen liefern werden! Literatur
[1] Unger, R. H. (2003) Lipid overload and overflow: metabolic trauma and the metabolic syndrome. Bild: © istockphoto.com|liewy |
L&M 8 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |