|
Mehrzweckwaffe mit ungewöhnlichem biotechnologischen Potenzial
Mehrzweckwaffe mit ungewöhnlichem biotechnologischen PotenzialDie nützlichsten Viren für die Menschheit
Masern, Grippe, Ebola – bei Viren denkt man meistens an gefährliche, Die Schlaffsucht der Seidenraupen Als im Jahr 1865 die damals bedeutende südfranzösische Seidenproduktion vor dem Kollaps stand, weil die Seidenraupen an den beiden Krankheiten Pebrine (Flecksucht) und Flacherie (Schlaffsucht) dahinsiechten, beauftragte die Zentralregierung in Paris den damals bereits berühmten Louis Pasteur persönlich, sich des Problems anzunehmen. Und so verbrachte Pasteur mehrere Sommer im Midi, um die Ursachen und Gegenmaßnahmen dieser Insektenkrankheiten, von denen man heute weiß, dass sie von dem Mikrosporidium Nosema bombycis und einem Insektenvirus verursacht werden, zu erforschen. Zwar sollte es noch mehrere Jahrzehnte dauern, bis Viren als submikroskopische infektiöse Agentien entdeckt wurden, doch gelten die damaligen Arbeiten Pasteurs über die Krankheiten der Seidenraupe bis heute als Meilenstein der Insektenpathologie. Was Pasteur nicht wissen konnte: Die Schlaffsucht der Seidenraupen wird von einem Virus verursacht, welches zur heute größten bekannten Virengruppe, den so genannten Baculoviren, gehört.
Abb.1 Rasterelektronische Aufnahmen von Nucleopolyhedroviren (NPV) (links) und Granuloviren (GV) (rechts). Die Insets zeigen transmissionsmikroskopische Aufnahmen eines einzelnen Einschlusskörpers. Man beachte die unterschiedliche Größe der Einschlusskörper (Maßstab!) und Anzahl von Viruspartikeln in den Einschlusskörpern bei NPV und GV. Bilder: JKI, K. Richert-Pöggeler, A. Huger und R. Kleespies
Uralte Viren für neue Aufgaben Baculoviren wurden von über 600 verschiedenen Insekten isoliert und befallen ausschließlich die Larvenstadien von Arten der Ordnungen Lepidoptera (Schmetterlinge), Hymenoptera (Hautflügler) und Diptera (Zweiflügler). Sie haben ein doppelsträngiges zirkuläres DNA-Genom mit einer Größe von 90-180 kbp, das für 90–190 Proteine kodiert [1]. Die Viren haben ihren Ursprung vermutlich in der Karbonzeit vor über 300 Mio. Jahren und haben sich im Laufe ihrer Evolution extrem eng an die Lebensweise von Insekten angepasst. Als natürliches Insektenpathogen tragen Baculoviren oftmals zum vorübergehenden Zusammenbruch von Insektenpopulationen bei, wenn diese zu Monsterdichten heranwachsen. Eine Hauptanpassung an die Biologie ihrer Wirte stellt die Bildung eines Einschlusskörpers dar. Während die meisten tierischen Viren von einer Membran zellulären Ursprungs umgeben und dadurch sehr labil gegen alkoholische Lösungen oder Detergentien sind, umhüllen sich Baculoviren mit einem Proteinpanzer, dem so genannten Einschlusskörper, der ihr Überdauern außerhalb eines Wirtes über einen längeren Zeitraum erlaubt (siehe Abb.1). Er hat damit dieselbe ökologische Funktion wie eine bakterielle oder pilzliche Spore. Der Einschlusskörper wird mit der Nahrung von den Insektenlarven aufgenommen, er löst sich im alkalischen Mitteldarm auf und setzt seine tödliche Virenpackung frei. Zunächst werden Epithelzellen des Mitteldarms infiziert, von dort breitet sich die Infektion in andere Organe aus und die befallenen Larven sterben innerhalb weniger Tage unter Freisetzung von Milliarden neuer Einschlusskörper (Abb.2). Um ihre Vermehrung zu optimieren, bedienen sich Baculoviren genetischer Waffen, die sie sich im Laufe der Evolution vermutlich von ihren Wirten oder auch von Bakterien entliehen haben. Hierzu zählt zum Beispiel ein Gen für eine Ecdysteroid-Glycosyl-Transferase, die in den Häutungsstoffwechsel der Larven eingreift und diesen blockiert [2]. Dadurch wird der Todeskampf der Larven so lange hinausgezögert, bis die Replikation der Viren vollständig abgeschlossen ist. Eine virus-kodierte Protease und Chitinase, wahrscheinlich bakteriellen Ursprungs, dienen schließlich dazu, die Kutikula der Larvenkadaver aufzulösen, wodurch die neu synthetisierten Einschlusskörper effizienter in der Umwelt verteilt und von neuen Larven gefressen werden können.
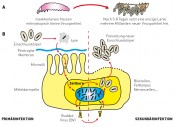
Abb.2 Infektionszyklus des Apfelwicklergranulovirus. A) Die im Einschlusskörper eingeschlossenen Viruspartikel werden mit dem Fraß aufgenommen. Die infizierte Larve stirbt innerhalb weniger Tage. Die Larvenkadaver zerfließen häufig und setzen neue Einschlusskörper frei. B) Die aufgenommenen Einschlusskörper lösen sich unter den alkalischen Bedingungen (hoher pH-Wert!) des Mitteldarms auf (Lyse) und setzen die infektiösen Viruspartikel frei. Diese überwinden die peritrophe Membran und binden an die Microvilli der Mitteldarmzellen. Die Viruspartikel werden zum Zellkern transportiert, wo sich ein virogenes Stroma bildet und eine erste Vermehrung stattfindet (Primärinfektion). Aus dieser Primärinfektion gehen neue, nicht eingeschlossene Viren (Budded Virus, BV) hervor, die sich mit der Zellmembran der infizierten Wirtszelle umgeben. Dadurch sind sie für die Immunabwehr des Wirtes nicht erkennbar. Die nicht eingeschlossenen Viren (BV) verursachen Sekundärinfektionen in anderen Zelltypen wie z.?B. Hämozyten oder Fettkörperzellen. Erst gegen Ende des Vermehrungszyklus werden wieder eingeschlossene Viren gebildet, die durch den Zerfall der infizierten Zellen und des Larvenkadavers freigesetzt werden.
Baculoviren als Protein-Expression-Factories Der Einschlusskörper von Baculoviren besteht aus einem einzigen Protein, dem so genannten Polyhedrin, das von den befallenen Zellen am Ende der Infektion in extrem großen Mengen (bis zu 60% des Zellproteins) exprimiert wird (Abb.3). Gleichzeitig wird dieses Protein für die eigentliche Replikation der Viren in Zellkultur nicht benötigt. Deshalb kann dessen kodierendes offenes Leseraster (ORF) durch ein beliebiges ORF ersetzt werden, wodurch ein heterologes Protein exprimiert wird. Auf der spezifischen Funktion des sehr starken Promotors des Polyhedrin-Gens beruht das 1983 auf Basis des Autographa californica Nucleopolyhedrovirus (AcMNPV) entwickelte Baculovirus-Expressionsvektor-System, das die Expression heterologer Proteine in Insektenzellen ermöglicht und eines der leistungsstärksten eukaryontischen Expressionssysteme darstellt [3]. Dieses wird heute nicht nur für Forschungszwecke, sondern insbesondere in der Pharmazie zur Expression rekombinanter Impfstoffe eingesetzt. Beispielsweise wird ein rekombinanter Impfstoff gegen humane Papillomaviren, die Zervixkarzinome (Gebärmutterhalskrebs) verursachen, mithilfe des Baculovirus-Expressionsvektor-System hergestellt.
Abb.3 NPV-infizierte Zellkultur von Agrotis ipsilon (100-fach vergrößert). Man beachte die gut sichtbaren viralen Einschlusskörper in den Kernen der infizierten Zellen. Bild: JKI, G. Gueli Alletti
Baculoviren als biologische Pflanzenschutzmittel Neben der biotechnischen Anwendung des Expressionssystems haben Baculoviren eine weitere nützliche Rolle für den Menschen – nämlich als biologische Pflanzenschutzmittel. Hier greift man auf ihre hohe Virulenz und ihre ausgeprägte Wirtsspezifität für einzelne Insektenarten zurück. Nach intensiven Entwicklungsarbeiten und umfänglichen Sicherheitsstudien, die bereits in den 1960er-Jahren begannen, werden heute weltweit etwa 30 verschiedene Baculoviren zur biologischen Bekämpfung von Schadinsekten eingesetzt. Sie gelten derzeit als die unbedenklichsten und spezifischsten Insektizide auf dem Markt. Allein das im Apfelanbau zur Bekämpfung der Obstmade eingesetzte Apfelwicklergranulovirus (CpGV) ist in mehr als 30 Ländern als Pflanzenschutzmittel zugelassen und wird weltweit praktisch in allen Apfel- und Birnenanbaugebieten eingesetzt (Abb.4, 5). In Deutschland wird es auf ca. 30% der Kernobstfläche angewandt [4]. Es ist ein Schlüsselmittel zur Obstmadenbekämpfung im Bioanbau und auch für den Klein- und Hausgarten wegen seiner Unbedenklichkeit gut geeignet.
Abb.4 Larve des Apfelwicklers (Obstmade), Cydia pomonella: weltweit verbreiteter Hauptschädling im Apfelanbau Bild: DLR Rheinpfalz, S. Asser-Kaiser
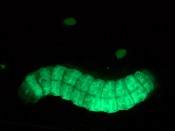
Abb.5 (erste oben) Apfelwicklerzellkultur, infiziert mit Green Fluorescent Protein (GFP)-markiertem Virus. Infizierte Zellen leuchten grün; (zweite oben) Apfelwicklerlarve, infiziert mit GFP-markiertem Virus Bilder: JKI, J. Frank
Aufgrund der hohen physikalischen Stabilität des Einschlusskörpers können die Viren über lange Zeit einfach gelagert und mit konventionellen landwirtschaftlichen Spritzgeräten ausgebracht werden. Ihre UV-Sensibilität limitiert ihre Persistenz in der Umwelt, was aber andererseits dazu führt, dass die Viren bis zu 10-mal pro Saison gespritzt werden. Kein anderes Insektizid darf annähernd oft im Laufe einer Saison verwendet werden. Erstmalig Resistenz gegen kommerzielle Viruspräparate Der häufige und oft ausschließliche Einsatz des Apfelwicklergranulovirus, insbesondere im Bioanbau, führte zur Entstehung von Apfelwicklerpopulationen mit einer ausgeprägten Virusresistenz. Diese wurde erstmalig 2004 in Süddeutschland beobachtet. Heute kennt man fast 40 resistente Apfelwicklerpopulationen in sieben mitteleuropäischen Ländern, darunter in Frankreich, Italien, Schweiz, Österreich, Tschechien und den Niederlanden [5]. Es handelte sich hierbei um die erste beobachtete Freilandresistenz gegen ein kommerzielles Baculovirusprodukt, schockierend war das bis zu 100.000-fache Resistenzniveau einzelner Populationen. Auf der Basis von Kreuzungsexperimenten, die in unserem Labor durchgeführt wurden, konnte nachgewiesen werden, dass das Resistenzallel dominant vererbt wird und auf dem Z-Chromosom des Apfelwicklers lokalisiert ist. Das Z-Chromosom ist eines der Geschlechtschromosomen des Apfelwicklers und dem menschlichen X-Chromosom vergleichbar, wobei anders als beim Menschen männliche Apfelwickler homogametisch, also vom Typ ZZ sind, während Apfelwicklerweibchen heterogametisch sind, also einen ZW-Typ aufweisen. Die Kombination aus Z-chromosomaler und dominanter Vererbung, wie sie bei der CpGV-Resistenz beobachtet wurde, stellt einen besonders effizienten Vererbungsmodus dar, der unter Selektionsdruck zu einer schnellen Eliminierung anfälliger Individuen und damit zu einem sehr schnellen Aufbau resistenter Populationen führt [6]. Für die betroffenen Apfelanbauer war dies zunächst ein existenzbedrohender Worst-Case. Neue Virusisolate helfen Obstbauern Erfreulicherweise konnten sehr schnell weitere CpGV-Isolate entdeckt werden, die überraschenderweise in der Lage waren, die beobachtete Resistenz zu brechen. Obwohl der Resistenzmechanismus bei den Insekten noch nicht entschlüsselt ist, konnte nach mehrjährigen umfangreichen molekularen Analysen die Ursache der Resistenzbrechung aufgeklärt werden [7]. Nachdem die Genome mehrerer resistenzbrechender CpGV-Isolate sequenziert wurden, konnte nur ein einziger gemeinsamer Unterschied zwischen allen resistenzbrechenden Isolaten und dem resistenzanfälligen kommerziellen Isolat gefunden werden: Das kommerziell verwendete Isolat enthielt eine Insertion von 24 Nukleotiden in einem essenziellen Gen namens pe38, dessen genaue Funktion allerdings noch nicht entschlüsselt ist. Durch die Insertion wurde ein kurzes, nur vier Aminosäuren langes Motiv im dazugehörigen Protein des resistenzanfälligen CpGV-Isolats verdreifacht. Wurde dieses Gen aus dem Virusgenom entfernt, verlor das Virus seine Infektiosität auch für anfällige Larven. Wurde das Gen pe38 hingegen von einem resistenzbrechenden Isolat in das resistenzanfällige kommerzielle Isolat übertragen, wurde dieses auch für resistente Apfelwickler infektiös. Damit war der Nachweis erbracht, dass die CpGV-Resistenz offensichtlich gegen das virale Gen pe38 gerichtet ist, dieses aber bei resistenzbrechenden Virusisolaten in einer anderen Form vorliegt. Damit steht ein genetischer Marker zur Verfügung, der eine einfache Identifizierung resistenzbrechender CpGV-Isolate ermöglicht. Perspektiven Einige der resistenzbrechenden Virusisolate sind mittlerweile zugelassen und tragen dazu bei, die resistenten Apfelwicklerpopulationen in Schach zu halten. Ob und wie schnell der Apfelwickler auch gegen diese Virusisolate eine Resistenz nachrüsten kann, bleibt abzuwarten. Es ist ein genetischer Wettkampf auf Leben und Tod. Als Konsequenz der aufgetretenen Resistenz verbietet sich eine weithin unbekümmerte und ausschließlich auf einem einzigen Präparat beruhende Bekämpfungsstrategie des Apfelwicklers. Vielmehr muss auch im Bioanbau, dem wegen des Verzichts auf chemische Pestizide nur eingeschränkte Möglichkeiten der Schädlingsbekämpfung zur Verfügung stehen, im Sinne eines wirkungsvollen Resistenzmanagements ein größeres Repertoire an Bekämpfungsoptionen bereitgehalten werden. Hierzu bietet sich die Kombination mit weiteren biologischen und biotechnischen Verfahren an. Erfreulicherweise wurde das Phänomen einer Resistenz gegen kommerzielle Baculoviruspräparate bisher nur beim Apfelwicklergranulovirus beobachtet. Bei anderen Baculoviren wie z.B. den Nucleopolyhedroviren scheint diese Gefahr geringer, da hier ein Einschlusskörper mehrere 100 Viruspartikel enthält, die sich in ihrer genetischen Ausstattung geringfügig voneinander unterscheiden können. Diese genetische Heterogenität innerhalb der viralen Einschlusskörper sollte es Insekten erschweren, eine Resistenz zu entwickeln. Das Baculovirus-Expressionsvektorsystem und dessen biotechnologische Anwendung, Baculoviren als biologische Pflanzenschutzmittel und neuere Forschungslinien zur Verwendung von Baculoviren als ungefährliche Genfähren in der somatischen Gentherapie, sind herausragende Beispiele, wie die vielfältigen biologischen Eigenschaften dieser Viren nutzbringend für den Menschen eingesetzt werden können. Nicht zuletzt wegen dieser Eigenschaften bezeichnete die große amerikanische Virologin Lois Miller (1945–1999) Baculoviren als: „Of all viruses known to mankind, baculoviruses are the most beneficial from an anthropocentric viewpoint.“ Dieser Satz gilt heute mehr denn je, haben diese ungewöhnlichen Insektenviren doch nichts von ihrer herausragenden wirtschaftlichen Bedeutung und ihrer wissenschaftlichen Faszination verloren.
Literatur Bild: © istockphoto.com|?baona |
L&M 4 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |