|
Spezialist Schwamm
Spezialist SchwammEntwicklung neuer Antifouling-Strategien marinen UrsprungsDie Problematik des Foulings ist so alt wie die Schifffahrt selbst und beschäftigt die Menschheit ebenso lange. Der chemische Köcher im Kampf gegen die unerwünschte Besiedelung scheint heute nahezu leer. Marine Schwämme sind uns auf diesem Sektor evolutionär weit voraus und damit neue Hoffnungsträger der marinen Industrien im Kampf gegen das Fouling. Biofouling und seine Folgen Unter Fouling versteht man den Bewuchs von submersen Oberflächen wie beispielsweise Schiffsrümpfen durch meist komplexe Kolonien an Mikroben, Algen, Seepocken, Muscheln und anderen sessilen Meeresorganismen. Eine massive Zunahme an Gewicht und hydrodynamischem Widerstand sowie verkürzte Wartungsintervalle führen zu erheblichen Mehrkosten für die Schifffahrt. Die US-Navy beziffert die Steigerung des Reibungswiderstands, verursacht durch Seepocken, (Balanidae) auf bis zu 60%, was bei einer um 10% reduzierten Geschwindigkeit zu einem um 40% gesteigerten Kraftstoffverbrauch der Schiffe führt. Allein für ihre Flotte schätzt sie die jährlichen Kosten, bewirkt durch Biofouling, auf 700 Mio. Euro. Neben der wirtschaftlichen ist vor allem die ökologische Komponente in Zeiten globaler Erwärmung und einer sich immer mehr ökologisch sensibilisierenden Gesellschaft von enormem Interesse. Bis 2020 soll der durch Fouling verursachte Mehrverbrauch an fossilen Brennstoffen auf den Weltmeeren zu einer Steigerung der Emissionen an den Treibhausgasen CO2 und SO2 von bis zu 72% führen [1].
Abb.1 Vom Biofouling befallenes Containerschiff. Bild: © Simone Miljanovic
Schon die frühen Karthager erkannten das Problem des Foulings für die Schifffahrt und entwickelten kupferhaltige Überzüge zum Schutze ihrer Flotte. Bis heute begegnet man dem unerwünschten Bewuchs mit schwermetallhaltigen Bootslacken. Hier sind heute meist Kupfer- und Zinkpyrithionen auf den Rümpfen von kleinen Segeljollen bis hin zu großen Containerschiffen zu finden. Bis 2008 waren neben diesen vor allem Organozinnverbindungen wie das Tributylzinnhydrid (TBT) Bestandteil von Antifouling-Lacken. Eingearbeitet in einen erodierenden Lack, kommt es durch das TBT zu einer permanenten und damit sehr effektiven lokalen Hemmung von Fouling-Organismen. Aufgrund hormonartiger Wirkungen und der daraus resultierenden hohen Toxizität für Meeresorganismen, die durch Anreicherung in der Nahrungskette letzten Endes auch den Menschen direkt betrifft, sind zinnorganische Verbindungen heute weltweit von der Internationalen Seeschifffahrts-Organisation (IMO) als Antifouling-Zusätze verboten. Auch für oben genannte kupferhaltige Anstriche ist aufgrund der zunehmenden Schwermetallbelastung der Weltmeere eine ähnliche Einstufung zu erwarten, was der Schifffahrt ihre aktuell scheinbar letzte Option im Kampf gegen das Fouling nehmen würde. Um neue, umweltverträgliche Antifouling-Strategien zu entwickeln, ist es notwendig, zunächst die grundlegenden Prozesse, die über mehrere Phasen erfolgen, zu differenzieren (siehe Abb. 2).
Abb.2 (A) Phasen des Biofouling-Prozesses: I) Konditionierung der Oberfläche durch Salze, Kohlenhydrate, Proteine und Glykoproteine. II) Adsorption von Bakterien (z.B. Vibrio harveyi) und Kieselalgen („Mikro-Fouling“). III) „Weiches Makro-Fouling“ vor allem durch kleine Invertebraten und Algen (z.B. Enteromorpha intestinales). IV) „Hartes Makro-Fouling“ durch größere Invertebraten (z.B. Mytilus edulis und Balanus amphritite). (B) Suppression der Oberflächenbesiedelung durch den Schwammmetaboliten Dibromhemibastadin (DBHB): Wachstumshemmung gegenüber V. harveyi (II) und antiadhäsive Eigenschaften gegenüber Invertebraten (IV) aufgrund von Phenoloxidase-Hemmung und daraus resultierender verminderter Produktion von Bioklebstoffen. Bild: © Simone Miljanovic
Der Prozess des Foulings wird anhand der jeweils beteiligten Fouling-Organismen, den so genannten Epibionten, grob in zwei Phasen unterteilt: das Mikro- und Makro-Fouling. Im ersten Schritt des Mikro-Foulings bildet sich bereits innerhalb weniger Minuten auf der submersen Oberfläche ein Film aus organischen und anorganischen Verbindungen, bedingt durch van der Waals-Kräfte und elektrostatische Wechselwirkungen. Die so größtenteils durch Salze, Kohlenhydrate, Proteine und Glykoproteine konditionierte Oberfläche bildet die Grundlage für die Adsorption der ersten einzelligen Organismen. Innerhalb von 24 Stunden entwickelt sich ein Film aus unterschiedlichsten Mikroorganismen, darunter vor allem Bakterien und Kieselalgen, der bereits die erste Form des Foulings darstellt. Durch Sekretion extrazellulärer polymerer Substanzen (EPS) formen die adhärierten Mikroorganismen eine gelartige Matrix, die nicht nur ihre Anheftung an die Oberfläche, sondern auch den Austausch von Nährstoffen, enzymatische Interaktionen und Schutz gegen Umwelteinflüsse und Biozide gewährleistet. Aufgrund einer hohen Stoffwechselaktivität innerhalb der Matrix kommt es bereits in dieser initialen Phase vermehrt zur Korrosion der Metalloberfläche. Nach der Bildung dieses Films schließt sich das Makro-Fouling an, das zunächst durch kleinere Eukaryoten wie Invertebraten und Algen (z.B. Enteromorpha intestinalis) gekennzeichnet ist. Dieses Stadium wird auch als „weiches Makro-Fouling“ bezeichnet, woran sich in der Folge das „harte Makro-Fouling” anknüpft. Ab diesem Stadium sind vermehrt größere Invertebraten wie Seepocken und Miesmuscheln (Mytilus edulis) in der Fouling-Kolonie zu finden [2]. Im Falle der Miesmuschel erfolgt eine Oberflächenanheftung mittels Ausbildung eines festen Bioklebstoffs, der enzymatisch aus Vorläuferproteinen, den M. edulis-Fußproteinen (Mefp), gebildet wird [3]. Schlüsselenzym dabei ist eine Phenoloxidase (E.C. 1.14.18.1), die vermehrt in den nahe des Muschelfußes lokalisierten Byssusdrüsen der Schalentiere exprimiert wird [4]. In der Gesamtheit entsteht somit durch Fouling-Prozesse innerhalb weniger Wochen ein hochkomplexes Gefüge verschiedenster Organismen, das nur unter großem mechanischen Aufwand wieder von dem besiedelten Substrat gelöst werden kann. Das chemische Arsenal mariner Schwämme Gemäß der Idee, dass sich die Natur nur beherrschen lässt, indem man sie selbst zum Leitbild macht, weisen marine Schwämme (Porifera) einen möglichen Ausweg aus der Fouling-Problematik. Diese ältesten vielzelligen Organismen der Erde, deren Existenz auf ca. 750 Mio. Jahre geschätzt wird, setzen sich evolutionär seit jeher mit dem Kampf gegen den Bewuchs durch schädliche Epibionten auseinander. Als so genannte Nahrungsfiltrierer sind für den Schwamm effektive Abwehrmechanismen gegen die Besiedelung durch Kleinst- oder Kleinlebewesen notwendig, um Porenfreiheit und damit ein Überleben gewährleisten zu können. Schwämme sind nicht zuletzt deshalb seit Jahrmillionen einem hohen evolutionären Druck ausgesetzt, der im Zuge der stetigen Anpassung zur Ausprägung von Sekundärstoffwechselwegen führte, die eine Vielzahl hochpotenter Metaboliten hervorgebracht haben. Das hohe Potenzial an bioaktiven Schwamminhaltsstoffen verdeutlicht ein Blick auf den amerikanischen Arzneimittelmarkt, wo mit Cytarabin (Cytosar-U®, Zytostatikum), Vidarabin (Vira-A®, Virostatikum) und Eribulinmesylat (Halaven®, Zytostatikum) drei der acht zugelassenen Arzneimittel marinen Ursprungs Schwammisolate zur strukturellen Blaupause haben. Soweit ist die Forschung und Entwicklung in Bezug auf Metaboliten aus dem Elefantenohrschwamm (Ianthella basta), der vor allem in den tropischen Gewässern des Indopazifiks und des Great Barrier Reefs beheimatet ist, noch nicht fortgeschritten, doch auch diese Schwammart ist für die Bildung und Akkumulation von höchst bioaktiven Verbindungen bekannt: Die so genannten Bastadine sind peptidartige Moleküle, bestehend aus bis zu je drei amidisch verknüpften Tyrosin- und Tyramineinheiten mit stark variierendem Bromierungsgrad in den phenolischen Aromaten, die im Schwammgewebe überwiegend als makrozyklische Arylether zu finden sind. Eine strukturelle Besonderheit aller Bastadine besteht in der zum Oxim oxidierten Aminfunktion der Tyrosineinheiten. Bastadine wurden 1980 erstmals von Kazlauskas et al. [5] isoliert. Die Substanzklasse zählt bis heute knapp 30 Derivate, die in weit über 100 wissenschaftlichen Studien Erwähnung finden. Neben antibakteriellen [6], antitumoralen [7] und Effekten auf den zellulären Calciumspiegel [8] zeigen Bastadine vor allem ausgeprägte Antifouling-Eigenschaften [9, 10] und können somit im Falle des Elefantenohrschwammes eindeutig als ein Schlüssel zur bewuchsfreien Schwammoberfläche bezeichnet werden (siehe Abb.3).
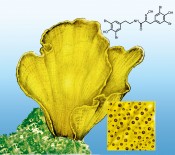
Abb.3 Mariner Schwamm Ianthella basta, der seine Oberfläche und die enthaltenen Poren (Vergrößerung) durch Bromtyrosine wie die Hemibastadine (hier abgebildet: Dibromhemibastadin) vor schädlichem Bewuchs durch Fouling-Organismen schützt. Bild: © Simone Miljanovic
Dieses Prinzip des Schwammes gilt es biomimetisch für verschiedene Anwendungszwecke im marinen Sektor, vor allem aber für die Schifffahrt, nutzbar zu machen. Studien am Institut für Pharmazeutische Biologie und Biotechnologie an der Heinrich-Heine-Universität Düsseldorf haben gezeigt, dass für eine hohe Antifouling-Aktivität bereits ein „halbes“ Bastadin, genannt Hemibastadin, ausreicht [9, 10]. In Besiedlungsversuchen mit Seepockenlarven lag die Antifouling-Wirkung der Hemibastadine auf vergleichbar hohem Niveau wie die der Bastadine, bei jedoch stark verringerter Toxizität gegenüber den untersuchten Epibionten [10]. Diese Kriterien – hohe Effektivität bei gleichzeitig nur geringer Toxizität gegenüber Meeresorganismen – sollten als Grundvoraussetzungen an moderne Antifouling-Strategien gestellt werden. Eine vergleichsweise geringe strukturelle Komplexität erlaubt zudem die Totalsynthese der Hemibastadine, was einen Einsatz auch als Zusatz in Schiffslacken ermöglicht, ohne Bestände des Elefantenohrschwammes zu gefährden. Hemmmechanismen der Hemibastadine Im Detail zeigen die Hemibastadine an zwei essenziellen Stellen des Fouling-Prozesses ihr Interventionspotenzial: Ein stark wachstumshemmender Effekt auf marine Keime der Gattung Vibrio, die häufig mit oben erwähnten Prozessen des Mikro-Foulings assoziiert werden, konnte dem synthetischen Dibromhemibastadin (DBHB) nachgewiesen werden. Speziell der untersuchte Keim Vibrio harveyi stellt neben seiner Beteiligung am Fouling auch ein großes Problem für die weltweite Aquakultur dar. Er gilt als Verursacher der Vibriose, die sowohl Wirbeltiere als auch Wirbellose gleichermaßen betreffen kann. Das häufig letal verlaufende Krankheitsbild äußert sich bei Fischen z.B. in schweren dermalen Läsionen und gastro-enteritischen Symptomen, während Garnelen aufgrund der durch den Keim verursachten Biolumineszenz unter der so genannten leuchtenden Vibriose leiden. Mit einer Wachstumshemmung gegenüber diesem Erreger auf Niveau von gängigen Antibiotika wie Chloramphenicol könnten die Hemibastadine daher auch in der Aquakultur von Nutzen sein. Ein zweiter Ansatzpunkt der Hemibastadine, Fouling-Prozesse zu unterbinden, findet sich in einer hohen Aktivität gegenüber der oben erwähnten Phenoloxidase aus der Miesmuschel. Hier konnte bereits die (alfa)-Hydroxyiminoamid-Partialstruktur der Hemibastadine als essenzielles pharmakophores Element für die Inhibition des kupferhaltigen Enzyms ausgemacht werden [9]. Mit diesem dualen Wirkmechanismus scheinen die Hemibastadine nicht nur für den Schwamm eine geniale Waffe im Kampf gegen das Fouling zu sein. Zukünftige Entwicklung Am Institut für Pharmazeutische Biologie und Biotechnologie werden nun mögliche Anwendungsformen untersucht, um das Potenzial der Schwammmetaboliten optimal auszunutzen. Ein Beispiel ist die Einbindung des Hemibastadins an ein Polymer, das als Antifouling-Lack an Schiffsrümpfen und Netzen für die Aquakultur zukünftig eingesetzt werden könnte. Denn wer könnte ein besseres Vorbild sein als Mutter Natur selbst?! Die Autoren danken Frau Simone Miljanovic für die Erstellung der Abbildungsillustrationen. *Literatur
[1] Salta, M. et al. (2008) Phil. Trans. R. Soc. A 368: 4729–4754 Bild: © Bernard Dupont* |
L&M 4 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |