|
Forscher
>
Dr. Ute Neugebauer
>
Potenzial und Grenzen Raman-spektroskopischer Verfahren in der medizinischen Diagnostik
Potenzial und Grenzen Raman-spektroskopischer Verfahren in der medizinischen DiagnostikSchnelle und schonende AufklärungAngesichts einer zunehmenden Überalterung der Bevölkerung stehen wir vor der wachsenden Herausforderung, bezahlbare und nachhaltige Gesundheitssysteme zu gewährleisten. Nur die Entwicklung neuer Methoden und Geräte, mit denen Krankheiten möglichst früh entdeckt und bekämpft werden können, am besten bereits dann, wenn erste krankhafte Veränderungen auf der molekularen Ebene auftreten, kann einen drohenden Kollaps dieser Systeme vermeiden helfen. Aufgrund der besonderen Eigenschaften des Lichts sind photonische Lösungen und insbesondere die Raman-Spektroskopie und ihre Varianten hierzu besonders viel versprechend. So ermöglicht die Raman-Spektroskopie eine kontaktfreie Messung, die aber im Gegensatz z.B. zu anderen photonischen Lösungen ohne exogene Labels auskommt. Dies ist ein besonderer Vorteil, da für solche Labels die gleichen Zulassungshürden wie für Arzneimittel gelten. Darüber hinaus ist die Raman-Spektroskopie vergleichsweise schnell und präzise, was zukünftig eine besonders patientennahe und schonende Diagnostik ermöglicht. Insbesondere als bildgebende Methode verfügt sie im Zusammenspiel mit anderen optischen und insbesondere chemometrischen Methoden über eine hohe Spezifität bei gleichzeitig geringer oder keiner Invasivität. Weitere Vorteile der Raman-Spektroskopie sind die hohe räumliche Auflösung, eine geringe Probenpräparation und die schwache Raman-Signatur des Wassers und der damit verbundenen Möglichkeit, im wässrigen Milieu zu arbeiten. Einige exemplarische und ausgewählte Anwendungsmöglichkeiten im medizinischen und klinischen Bereich werden im Folgenden vorgestellt.
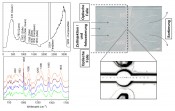
Abb.1 I) Raman-Spektren der biologischen Hauptbestandteile von Bakterien: Wasser, Protein, Nukeinsäuren (DNA), Kohlenhydrate und Fette. In den beispielhaft gezeigten Raman-Spektren verschiedener Staphylokokken-Stämme lassen sich verschiedene Banden der Einzelbestandteile erkennen. II) BiopartikelExplorer (Firma rapID). Zelldiagnostik Als Goldstandard in der Pathogen-Diagnostik gilt das Ansetzen und die Analyse einer Bakterienkultur. Dazu wird viel Zeit (u.U. bis zu eine Woche) und erfahrenes Fachpersonal benötigt. Ein solches Maß an Zeit steht aber beispielsweise bei Vorliegen einer Sepsis nicht zur Verfügung. Denn die Überlebensrate nach dem Einsetzen eines septischen Schockes ist bereits nach zwölf Stunden ohne gezielte Behandlung auf weniger als 1/5 abgesunken [1]. Raman-Spektroskopie hat das Potenzial, binnen weniger Stunden das auslösende Pathogen bestimmen zu helfen. Jede Bakterienspezies verfügt über eine individuelle Raman-Signatur, wobei das Spektrum eines einzelnen Bakteriums bereits zur Identifikation ausreichen kann [2]. Die Unterschiede zwischen den Spektren verschiedener Spezies sind oft subtil, was eine Zuordnung ohne Zuhilfenahme chemometrischer Methoden unmöglich macht. Das Spektrum eines Bakteriums setzt sich aus den spektralen Signaturen aller enthaltenen Stoffe wie Wasser, Proteine, Fette, Nukleinsäuren, Kohlenhydrate etc. zusammen (Abb.1-I). Deshalb ergeben sich subtile Unterschiede selbst in den Spektren verschiedener Bakterien einer Spezies durch unterschiedliches Alter, unterschiedliche Ernährungszustände und Umwelteinflüsse. Auf der Basis von Datenbanken, die Spektren von Bakterien in unterschiedlichen Zuständen enthalten, können chemometrischen Methoden die Raman-Spektren den entsprechenden Spezies zuordnen. Dazu wird ein Spektrum quasi in verschiedene, besonders aussagekräftige Bereiche zerlegt und diese werden mit den entsprechenden Bereichen der Spektren in der Datenbank verglichen. Damit lassen sich beinahe 99% der Bakterien der korrekten Spezies zuordnen [2]. Für den Nachweis von Bakterien in weniger komplexen Matrices, z.B. in der Luft von Reinräumen, ist eine entsprechende Lösung bereits kommerziell erhältlich (Biopartikelexplorer, RapID. Abb.1-II). Dabei wird die Fluoreszenzspektroskopie genutzt, um unbelebte Partikel und Bakterien zu unterscheiden. Letztere werden dann gezielt mithilfe der Raman-Spektroskopie identifiziert. In komplexeren Medien wie Speichel, Urin oder gar Blut müssen die Bakterien jedoch erst von diesen Medien separiert werden, da die Raman-Signaturen des Mediums sonst die Identifikation erschweren bzw. unmöglich machen. Dieser Abtrennungsschritt kann über mikrofluidische Chips erfolgen, die beispielsweise das Prinzip der Dielektrophorese nutzen, um Bakterien zu fangen, festzuhalten und damit der Messung zugänglich machen [3]. Damit ist eine Abtrennung vom Medium nicht mehr unbedingt erforderlich, sondern die Bakterien können auch direkt in Lösung vermessen werden. Letzteres erlaubt neben der reinen Identifikation auch Aussagen über die Anfälligkeit bzw. Resistenz der Bakterien gegenüber Antibiotika. Dazu werden mittels Raman-Spektroskopie Wachstumskurven der Bakterien unter Antibiotikumeinfluss vermessen. Innerhalb von zwei Stunden kann mit einer Sensitivität und Spezifität von jeweils 90% das Vorliegen einer Resistenz ermittelt werden. Neben Bakterien spielt auch die Diagnostik von Tumorzellen im Blut eine wichtige Rolle. Diese Zellen können sich von kanzerogenem Gewebe lösen, in den Blutstrom gelangen und Metastasen hervorrufen. Im Blutstrom sind vereinzelte Tumorzellen relativ gut zugänglich. Sie können mit einem Raman-spektroskopischen Verfahren ähnlich der optischen Flusssortierung diagnostiziert werden. Die Blutprobe wird dazu durch einen mikrofluidischen Chip geleitet. Zellen werden im Chip durch optische Fallen einzeln gefangen und mithilfe der Raman-Spektroskopie untersucht und klassifiziert. Anschließend erfolgt auf der Basis der Klassifizierung eine Sortierung zur weiteren Verwendung. Mittels Raman-Spektroskopie ist im Vergleich zur optischen Flusssortierung durch die schwingungsspektroskopische Charakterisierung eine wesentlich genauere Diagnostik der Einzelzelle möglich. Diese erfordert allerdings mehr Zeit und führt zu einem wesentlich geringeren Durchsatz (5–6 Zellen/Minute). Durch gerätetechnische Verbesserungen wird sich der Durchsatz freilich zukünftig noch deutlich verbessern lassen. Abbildung 2 zeigt einen entsprechenden Mikrofluidikchip aus Quarz [4]. Die aufgenommenen Raman-Spektren zeigen noch Einflüsse durch die spektralen Eigenschaften der optischen Filter, des Fanglasers und Substratmaterials. Diese müssen deshalb noch eliminiert werden, um eine erfolgreiche Klassifizierung zu ermöglichen und den spektralen Fingerabdruck von weißen Blutzellen (grün) und Tumorzellen (orangefarben, braun, blau) sichtbar zu machen.
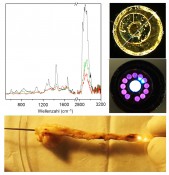
Abb.2 Mikrofluidchip für die Raman-aktivierte Zellsortierung Gewebediagnostik Nicht bei allen Tumoren ist eine radikale Entfernung gewünscht bzw. möglich. Dazu zählen beispielsweise Gehirntumore. Bei diesen sollte möglichst wenig gesundes Gewebe entfernt werden, was schwierig ist, denn Tumor und gesundes Gewebe sind oft nicht klar abgegrenzt. Generell wäre es wünschenswert, eine objektive Methode zur Verfügung zu haben, die direkt im OP angewendet werden kann. Der Idealfall wäre ein Operationsmikroskop, das die Grenzen des Tumors direkt abbildet. Zur Realisierung eines solchen Mikroskops wäre es von Vorteil, mehrere bildgebende, möglichst labelfreie Techniken zur Kontrastverstärkung zu kombinieren. Unserer Erfahrung nach ist die Kombination von Raman mit kohärenter Anti-Stokes-Raman-Streuung (CARS), der Zwei-Photonen-Fluoreszenzanregung (TPEF) unter Verwendung endogener Marker und der „Second Harmonic Generation“ (SHG) besonders viel versprechend [5]. Bei der Raman-Spektroskopie werden alle (Raman-aktiven) Schwingungsmoden gleichzeitig angeregt, wohingegen bei CARS durch die Überlagerung von drei verschiedenen, räumlich orientierten Lichtpulsen eine ausgesuchte Schwingung isoliert und kohärent angeregt wird, wodurch ein vierter, räumlich gerichteter und kohärenter Lichtpuls entsteht. Im Unterschied zu Raman-Imaging lässt sich dabei ein Bild durch den stark erhöhten Streuquerschnitt in einer wesentlich kürzeren Zeit aufnehmen (Faktor 104). Während Raman und CARS chemische Informationen bereitstellen, ergänzen SHG und TPEF diese um morphologische Details. SHG betont besonders geordnete, nicht zentrosymmetrische Strukturen wie z.B. Kollagen, wohingegen TPEF besonders auf endogen fluoreszierende Stoffe wie NAD(P)H, Flavine, Elastine usw. anspricht. In Abbildung 3 werden TPEF-, CARS und Raman-Mikroskopie-Bilder eines ungefärbten Hirntumordünnschnittes mit dem lichtmikroskopischen Bild des nachträglich mit Hämatoxylin und Eosin gefärbten Präparats verglichen. Speziell die Zellkerne, die mit allen Methoden aufgelöst werden, sind für die histopathologische Bewertung wichtig. Durch die kombinierten morphologischen und funktionellen Informationen hat dieser Ansatz das Potenzial, zum einen Tumore früh zu entdecken und zu klassifizieren und zum anderen die Tumorgrenzen mit ausreichender Genauigkeit und Verlässlichkeit zu lokalisieren.
Abb.3 Vergleich von TPEF-, CARS und Raman-Mikroskopie eines ungefärbten Hirntumordünnschnittes mit dem lichtmikroskopischen Bild des nachträglich mit Hämatoxylin und Eosin gefärbten Präparats (von links nach rechts: Raman, Lichtmikroskopie, TPEF, CARS).
Abb.4 Raman-endoskopische Untersuchung der Arterien eines Kaninchens. Organdiagnostik Zur endoskopischen Untersuchung von Plaques in Arterien ist eine Beurteilung der Morphologie nicht ausreichend, da so nicht beurteilt werden kann, ob eine Ablagerung ungefährlich ist oder sich eventuell von der Gefäßwand lösen und Verstopfungen hervorrufen und damit einen Herzinfarkt oder Schlaganfall auslösen kann. Da die Raman-Spektren von Kalziumphosphat, Bindegeweben, Triglyzeriden und Cholesterin charakteristisch sind, könnte über die endoskopische Raman-Spektroskopie die Plaque-Zusammensetzung und damit die Gefährlichkeit der Plaques bestimmt werden. Der Wert dieses diagnostischen Ansatzes wurde in Tierversuchen bereits bestätigt. In Abbildung 4 ist dargestellt, wie eine Sonde von 1mm Durchmesser mit einer zentralen Anregungsfaser und 12 Detektionsfasern für Ex-vivo-Messungen an Kaninchen benutzt wurde [6]. Dabei wurden die Messbedingungen so gewählt, dass In-vivo-Bedingungen simuliert wurden. Die Signale der Plaqueablagerungen sind hinsichtlich ihrer Intensität und spektralen Lage von Lipiden der Arterienwand mit Kollagenbanden und vom Blut mit Banden von roten Blutkörpern eindeutig zu unterscheiden. Auch hier sollte die Kombination von chemischen und morphologischen Informationen von Vorteil sein. Wir planen deshalb, die Raman-Spektroskopie mit optischer Kohärenztomografie und/oder Ultraschall zu kombinieren. Mittels Miniaturisierung wird es zudem möglich sein, auch feinere Arterien einer Messung zugänglich zu machen.
Literatur Foto: © 123rf.com| mikekiev |
L&M 3 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |