|
L&M-5-2008
>
Epigenetik
EpigenetikWie Gene ein und ausgeschaltet werden
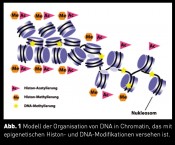
Prof. Dr. Ann E. Ehrenhofer-Murray, Zentrum für Medizinische Biotechnologie, Universität Duisburg-Essen Was unterscheidet die Raupe vom Schmetterling? Wohl kaum die DNA-Sequenz, denn die ist bei beiden faktisch identisch und dennoch sehen sie so verschieden aus. Der Unterschied liegt in der Art und Weise, wie die genetische Information umgesetzt wird und wann und wo die Gene abgelesen (transkribiert) werden. Dabei spielt eine wesentliche Rolle, in welcher molekularen Nachbarschaft sich das Gen befindet. Manche Nachbarschaften fördern die Expression, während andere sie verhindern, was auch als Genrepression oder „Gene Silencing“ bezeichnet wird. Dieses Phänomen ist die Grundlage für eine wiederentdeckte Disziplin, die Epigenetik: gleiche DNA-Sequenzen, aber unterschiedliche Expression. Intensive Forschung aus den letzten zehn Jahren hat wichtige Einblicke in die molekularen Grundlagen dieses Phänomens gewährt. Chromatin: Die Umgebung der Gene Die Grundlage für Genexpressionsunterschiede liegt in der Organisation der DNA in Chromatin, das im Zellkern vorliegt. Die Grundeinheit des Chromatins ist das Nukleosom, das aus kleinen Histonproteinen besteht, um die die DNA gewickelt ist (Abb. 1). Nukleosomen sind in einer Kette aneinandergereiht, die dann in höher organisierten Strukturen aufgedrillt ist. Unterschiede in der Chromatinfaser sind nun dadurch zu erklären, dass verschiedene Kombinationen chemischer Modifikationen an den Histonen und der DNA vorliegen. Am besten bekannt und untersucht sind dabei die Histon-Acetylierung und -Methylierung sowie DNA-Methylierung. Obwohl dies vergleichsweise kleine Modifikationen sind, haben sie dramatische Konsequenzen: Sie haben zur Folge, dass sich weitere Proteine an das Chromatin anlagern, die ihrerseits dessen Expression steuern. Zum Beispiel wird durch Histon-Acetylierung die Transkriptionsmaschinerie herangebracht und die Transkription stimuliert, wohingegen gewisse Klassen von Histon- Methylierung Repressoren rekrutieren. Dadurch kommen unterschiedliche Expressionsregionen im Genom zustande: Im Euchromatin sind die Gene exprimiert, während sie im Heterochromatin reprimiert sind. Epigenetische Unterschiede sind demnach molekular gesprochen unter anderem durch Unterschiede im Modifikationsmuster der Histone zu erklären, eine Einsicht, die in den letzten zehn Jahren gewonnen wurde. Ob es dabei einen „epigenetischen Code“ an den Histonen gibt, der dem universellen genetischen Code vergleichbar wäre, ist umstritten. Wenn ein solcher existiert, ist er um einiges komplexer als der genetische Code und er ist bislang nicht geknackt. Die Bäckerhefe als epigenetischer Mikrokosmos
Aus dem Aufbau des Chromatins ergeben sich einige interessante Fragen: Wie wird das Chromatin verdoppelt und wie wird dabei die epigenetische Information weitergegeben? Hat der Chromatinstatus auch einen Einfluss auf die DNA-Replikation? Wie wird sichergestellt, dass die epigenetischen Bereiche ihre Identität bewahren und nicht auf die benachbarten Regionen übergreifen? Unsere Arbeiten aus den letzten Jahren haben zum Verständnis dieser Fragen beigetragen. Um epigenetische Mechanismen aufzuklären, nutzen wir den Modellorganismus Saccharomyces cerevisiae, die Bäckerhefe. Sie besitzt eine Chromatin- und Chromosomenstruktur ähnlich einer menschlichen Zelle, lässt sich jedoch um einiges einfacher genetisch, molekularbiologisch und biochemisch bearbeiten. So ist es möglich, mithilfe der molekularen Werkzeuge, die wir für die Hefe besitzen, die Mechanismen des Chromatinaufbaus zu untersuchen. Das Hefegenom kann als eine „kompakte Variante“ eines eukaryoten Genoms bezeichnet werden, das sehr dicht mit Genen gepackt ist. Zudem besitzt die Hefe Gen- Regionen, die einer klassischen epigenetischen Regulation unterliegen: Die reprimierten Paarungstyp-Gene HML und HMR, die Telomere und der ribosomale DNA Locus. Gene Silencing in diesen Regionen kann durch Einfügen geeigneter Reporter-Gene sichtbar gemacht werden (Abb. 2). Zentrale Regulatoren der Repression in diesen Regionen sind die SIR (silent information regulator) Proteine, die an das Chromatin binden und Heterochromatin bilden, das sich am Rand des Zellkerns befindet (Abb. 3). Epigenetische Einflüsse auf Genexpression und DNA-Replikation Wir haben nun gefragt, wie das Heterochromatin an den Telomeren in Schach gehalten wird. Unsere Studien zeigen, dass es ein dynamisches Gleichgewicht an positiven und negativen histon-modifizierenden Aktivitäten gibt, die hier zusammenwirken. Wird eine davon ausgeschaltet, gewinnt eine andere die Oberhand. Besonders erstaunlich war, dass auch HDACs das Heterochromatin zurückdrängen können, indem sie dem Sir2 das Substrat entziehen, sodass es seinerseits nicht wirksam sein kann und somit die Heterochromatin- Ausbreitung gestoppt wird. Histon-Modifikationen beeinflussen nicht nur, wie die Gene exprimiert werden, sondern wirken sich auch auf andere Prozesse an der DNA aus. Vor jeder Zellteilung wird die DNA durch Replikation verdoppelt. Dazu muss die DNA aus der Chromatin-Verpackung gelöst und nach der Replikation wieder in Chromatin organisiert werden, ein Prozess, der nur unvollständig verstanden ist. Wir haben herausgefunden, dass HDACs durch DNA-bindende Proteine an Replikations-Startpunkte rekrutiert werden, dort die Histone deacetylieren und dadurch die Replikations-Initiation fördern. Dies zeigt, dass epigenetische Modifikationen nicht nur die Transkription, sondern auch die Replikation beeinflussen. Nach der Verdoppelung der DNA wird diese erneut in Chromatin verpackt, was auch Chromatin-Assemblierung genannt wird und von Assemblierungsfaktoren katalysiert wird. Dabei müssen die epigenetischen Modifikationsmuster wieder hergestellt werden, damit die Tochterzelle nicht nur genetisch, sondern auch epigenetisch mit der Mutterzelle identisch ist. Wir haben entdeckt, dass diese Assemblierungsfaktoren eine Histon- Acetyltransferase mitführen, die das neue Chromatin direkt bei seiner Herstellung acetyliert. Damit ist sichergestellt, dass auch neu eingebaute Histone das richtige Acetylierungsmuster aufweisen. Nature + Nurture = Genetik + Epigenetik Mithilfe der Bäckerhefe sind Untersuchungen epigenetischer Mechanismen möglich. Ziel ist natürlich eine Übertragung dieser Resultate auf höhere Organismen, um letztendlich menschliche Erkrankungen epigenetischen Ursprungs besser behandeln zu können. Obwohl die Forschung dazu noch in Kinderschuhen steckt, wird doch immer klarer, dass äußere Einflüsse die epigenetischen Muster beeinflussen können. Eine molekulare Erklärung des Einflusses der Umgebung („Nurture“) auf die Gene eines Organismus („Nature“) ist demnach, dass dadurch Histon-Modifikationen und DNA- Methylierungsmuster geändert werden, was zu Änderungen der Genexpression führt. Vielleicht haben daher mehr Erkrankungen als bisher vermutet einen epigenetischen Hintergrund. Weil dazu auch Volkskrankheiten wie Krebs und Fettleibigkeit gehören, könnten somit epigenetische Medikamente einen großen Beitrag dazu leisten, diese Erkrankungen zu bekämpfen. Fotos: © Prof. Dr. Ann E. Ehrenhofen-Murray
Weiterführende Literatur: |
L&M 5 / 2008
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |