|
Medizin
 >
Neuer Alzheimer-Mechanismus lässt auf baldige Therapien hoffen
>
Neuer Alzheimer-Mechanismus lässt auf baldige Therapien hoffen
Neuer Alzheimer-Mechanismus lässt auf baldige Therapien hoffenFehlerhafter AbtransportDie Alzheimer Demenz (AD) ist eine seit mehr als 100 Jahren beschriebene Erkrankung deren eigentliche Ursache bis heute noch immer nicht identifiziert ist, obwohl von aktuell mehr als 30 Mio. Erkrankten weltweit auszugehen ist. Neueste Hochrechnungen zeichnen ein dramatisches Szenario mit 106 – 360 Mio. Erkrankten im Jahre 2050. Es beginnt damit, dass man im Kaufhaus steht und plötzlich nicht mehr aus dem Laden findet oder einem der Weg nachhause nicht mehr einfallen will – zumindest ist dies oft der Zeitpunkt, an dem die meisten Betroffenen doch beschließen, zum Arzt zu gehen. Nach dem, was wir heute bereits wissen, beginnt die Krankheit allerdings schon sehr lange, bevor die ersten Symptome klinisch erkennbar werden. Nervenzellverlust
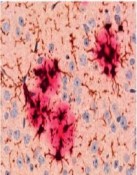
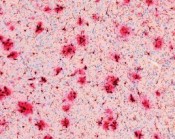
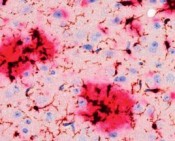
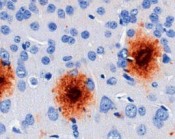
Im Laufe des Lebens reichern sich die Schnittprodukte des sog. Amyloid Precursor Proteins (APP, Amyloid-Vorläufer-Protein) im Gehirn an. Diese als „Aß“ bezeichneten Peptide gelten als jene, die eine Kaskade von verschiedenen pathologischen Ereignissen in Gang setzen und so letztlich zur AD führen. Dabei kommt es zunächst zur Zusammenlagerung der Peptide zu Aggregaten sehr unterschiedlicher Form und Größe. Es bilden sich lösliche Aggregate aus 2 bis etwa 12 Monomeren, die als oligomeres Aß bezeichnet werden. Daneben entstehen langkettige, unlösliche Strukturen, sog. Fibrillen, die sich zu einem der histologischen Hauptcharakteristika der AD zusammenlagern, den Aß-Plaques (Abb. 1). Die Plaques wie auch die neurofibrillären Tangles konnten schon 1905 von Alois Alzheimer durch Versilberung morphologisch sichtbar gemacht werden.
*Risikofaktor Alter* Wege zu früher Diagnostik Das fehlende Wissen um den Entstehungsmechanismus ist auch ein Grund für den Mangel an diagnostischen Instrumenten. Ärzte sind zwar in der Lage, die Krankheit mithilfe klinischer Erfahrung und mit Kognitionstests gut von anderen Demenzformen abzugrenzen, jedoch erst in einem Stadium, in dem eine Behandlung eigentlich schon zu spät kommt. Denn wenn auch in den letzten Jahren klar wurde, dass das Gehirn eine größere Fähigkeit zur Regeneration besitzt als ursprünglich angenommen, ist der Schaden in diesem Stadium der AD bereits viel zu groß, um die zerstörten Nervenzellen vollständig ersetzen zu können. Vor allem mithilfe von Substanzen, die an das Aß binden und mittels Positronen-Emissions-Tomografie (PET) nachgewiesen werden können und der Bestimmung von Aß 40 und 42 sowie von phosphoryliertem Tau-Protein im Nervenwasser der Patienten wird derzeit versucht, eine frühere Diagnostik zu erreichen. Diese Verfahren sind viel versprechend, aber leider bisher noch nicht gut genug, um eine effektive Frühdiagnostik zu ermöglichen. Ziel wäre es, die Krankheit in einem Stadium zu diagnostizieren, in dem noch gute Behandlungserfolge möglich wären, wenn zukünftig eine effektive Behandlung verfügbar sein wird. Transportproteine im Visier
Um all diese Anforderungen erfüllen zu können, braucht es in erster Linie einen pathogenetischen Mechanismus, der die sporadische Form der AD erklärt. Spätestens als im Dezember 2010 eine amerikanische Studie der University of Washington veröffentlicht wurde [1], in der gezeigt werden konnte, dass die Produktion von Aß in ADPatienten nicht höher ist als in Gesunden, kam die
Aß-Produktionshypothese stark ins Schwanken. In der gleichen Arbeit wurde allerdings auch gezeigt, dass offensichtlich der Abtransport des Aß aus dem Gehirn bei erkrankten Personen um 30 % reduziert ist. Nun wird schon seit einigen Jahren spekuliert, dass ein gestörter Abtransport von Aß zur AD führen könnte. Verantwortlich dafür wurde vor allem das Protein LRP1 gemacht, das auch im Fettstoffwechsel eine Rolle spielt. Jedoch blieben die Erfolge aus, dies als therapeutisches Ziel zu nutzen. Vor etwa 10 Jahren wurde jedoch mit dem ABCB1 Protein eine weitere Proteinsuperfamilie zu den möglichen Aß-Exportproteinen hinzugefügt. Das Forschungsinteresse war bisher nur sehr gering, trotz weiterer Hinweise darauf, dass das ABCB1 eine wesentliche Rolle bei der Erkrankung spielen könnte. ABCB1 gehört zur Superfamilie der ATP-binding-cassette-Transporter (ABC-Transporter). Diese Transportproteine haben Transporter mit Potenzial In diesem Zusammenhang ist es enorm wichtig, sich in Erinnerung zu rufen, welche physiologische Aufgabe (gerade diese beiden) ABC-Transporter haben. Sie sind hauptsächlich dafür verantwortlich zu machen, dass die meisten der Medikamente, die wir einnehmen, nicht ins Gehirn gelangen. Dieser Schutz hat jedoch gleichzeitig zur Folge, dass Transportkapazität zum Beispiel für das Aß nicht mehr vollständig zur Verfügung steht. Wenn man gleichzeitig noch eine sich verschlechternde Energieversorgung durch verringerte Durchblutung und alternde Mitochondrien hinzurechnet, entsteht ein Bild, das die Pathogenese der sporadischen AD mit erklären könnte. Ein Mechanismus mit derart starkem Einfluss bietet aber gleichzeitig ein hohes therapeutisches und diagnostisches Potenzial. Ist man in der Lage, die Aktivität von ABC-Transportern an der Blut-Hirn-Schranke gezielt zu erhöhen, hätte man eine viel versprechende Therapieoption. Nun ist es allerdings so, dass ABC-Transporter aufgrund ihrer evolutionären Natur bisher eher als Hindernis angesehen wurden, Medikamente an ihren Bestimmungsort zu bringen. Gerade in der Krebstherapie sind diese Proteine ein Dorn im Auge, da sie die Resistenz der Krebszellen gegen die Chemotherapeutika verursachen. Aus diesem Grund wurden fast ausschließlich Inhibitoren für die ABC-Transporter entwickelt und den Aktivatoren wenig Aufmerksamkeit gewidmet. Dennoch ist es uns gelungen ein Medikament (Thiethylperazin) zu finden, das die Aktivität von ABCC1 um etwa 70 % erhöht. Mäuse, die mit Thiethylperazin prophylaktisch (vor Beginn) und therapeutisch (nach Beginn der AD) behandelt wurden, hatten nach jeweils 25 Tagen weniger als die Hälfte Aß im Gehirn als unbehandelte Tiere. Aufgrund dieser Ergebnisse werden wir nun untersuchen, ob eine Aktivierung von ABCC1 grundsätzlich als Therapie bei AD-Patienten einsetzbar ist. Darüber hinaus wollen wir diesen Mechanismus für die Diagnostik nutzbar machen, denn bei Nachweis einer verminderten Transportkapazität von ABCC1 bei spezifischen Patienten kann man frühzeitig Gegenmaßnahmen ergreifen, die so die Erkrankung bis in ein höheres Alter hinauszögern könnten. Literatur
[1] Mawuenyega, K. G. et al. Decreased clearance of CNS beta-amyloid in Alzheimer's disease. Science 330, 1774 (2010). Foto: © Prof. Dr. Dr. Jens Pahnke |
L&M 6 / 2011
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |