|
Forscher
>
Dr. Alexander Bartelt
>
Bedeutung des braunen Fettgewebes für den Energiestoffwechsel
Bedeutung des braunen Fettgewebes für den EnergiestoffwechselBöses Fett – gutes FettÜbergewicht und erhöhte Blutfette sind weit verbreitete Risikofaktoren für die Entstehung von Diabetes und Herzkreislauferkrankungen und mittlerweile die kostenträchtigste Einzelursache für Krankheiten in Deutschland. Einen neuen therapeutischen Ansatz zur Behandlung dieser Volkskrankheiten bietet möglicherweise die Aktivierung des braunen Fettgewebes. In diesen spezialisierten Kraftwerken des Körpers können überschüssige Kalorien durch Verbrennung in Wärme umgewandelt und somit möglicherweise unschädlich gemacht werden.
Übergewicht (Adipositas) und die damit assoziierten Komorbiditäten entstehen, wenn die Energieaufnahme den Energieverbrauch überschreitet [1]. Sobald überschüssige Energie nicht verbraucht werden kann, wird diese als Reserve für schlechte Zeiten vor allem in weißem Fettgewebe gespeichert. Nach neuesten Studien der OECD sind nahezu 70 % der erwachsenen Bevölkerung in Europa und Nordamerika übergewichtig. Weltweit wird daher fieberhaft nach Lösungen gefahndet, um übergewichtigen Menschen das Abnehmen zu erleichtern – denn erfahrungsgemäß ist Abnehmen z.B. durch Reduktion der Nahrungsaufnahme allein für den Einzelnen nicht erfolgreich. Im Jahre 2009 allerdings wurde entdeckt, dass nicht nur Neugeborene, sondern auch erwachsene Menschen braunes Fettgewebe besitzen [2-4]. Dieses Gewebe dient dazu, die Körpertemperatur bei Kälte durch Verbrennung von Fetten aufrechtzuerhalten. Während das weiße Fettgewebe also Energie speichert, verbraucht das braune Fettgewebe Kalorien, um Wärmeenergie zur Aufrechterhaltung der Körpertemperatur zu erzeugen [5-6]. Gerade die Tatsache, dass das braune Fettgewebe aktiv energiehaltige Metabolite wie Glukose und Fettsäuren aus Triglyzeriden abbauen kann, hat zu der Hoffnung geführt, sich dieses Gewebe zur Bekämpfung von Übergewicht zu Nutze machen zu können. Leider scheint bei übergewichtigen Patienten die Stoffwechselaktivität des braunen Fettgewebes in Abhängigkeit vom Body-Mass-Index herabgesetzt zu sein [7]. Wohin mit den Fetten?
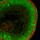
Fette sind wasserunlöslich und werden in Lipoproteinen verpackt durch den Körper transportiert (siehe Abb. 1). Ist der Abbau dieser Lipoproteine gestört, so lagern sich mit der Zeit Fette in der Gefäßwand ab und es entsteht Atherosklerose. Neben diesen schädlichen Ablagerungen in den Blutgefäßen, die Herzinfarkte und Schlaganfälle verursachen können, werden Fette in großen Nanopartikel zeigen den Weg Wie kommt man darauf, die quantitative Bedeutung eines prozentual an der Körpermasse eher unbedeutenden Organs für den systemischen Lipidtransport zu untersuchen? Inspiriert durch moderne PET-CT-Analysen, welche die Existenz signifikanter Mengen des braunen Fettgewebes auch beim erwachsenen Menschen nachgewiesen haben [2-4], haben wir Nanoteilchen zur Markierung von Lipoproteinen eingesetzt. Wie beim Trojanischen Pferd werden dazu Nanoteilchen in den Lipidkern der Lipoproteine versteckt, sodass wir die physikalischen Eigenschaften der Nanoteilchen zur molekularen Bildgebung nutzen können [10]. Bereits wenige Sekunden nach der Injektion der mit superparamagnetischen Nanoteilchen markierten Lipoproteine setzte sich in der dynamischen Magnetresonanztomografie das braune Fettgewebe kontrastreich von den umgebenden Organen in Abhängigkeit vom Aktivierungsgrad ab [9]. Weitere Untersuchungen folgten, letztendlich konnten erstmalig der Prozess der Fettverarbeitung im Blut und die anschließende Aufnahme der Fette in das braune Fettgewebe dynamisch und mit hoher Auflösung sichtbar gemacht werden – wir konnten somit zuschauen, wie die Lipoproteine im braunen Fettgewebe verarbeitet wurden. Der Weg der Fette scheint somit nicht zwangsläufig in das weiße Fettgewebe zu führen. Vielmehr wird er von der Umgebungstemperatur bestimmt. Braunes Fett – prima fürs Klima? Ist die Aktivierung ein Ansatz zur Reduktion des weißen Fettgewebes auch beim Menschen und könnten Gewichtsreduzierende Maßnahmen sich sogar positiv auf die Klimaerwärmung auswirken? Auch wenn die Fragen etwas provokativ verknüpft sind, kann man vermutlich beide bejahen. Dazu ein paar Fakten: In Abhängigkeit vom Geschlecht (Frauen haben mehr), vom Jahrgang (mit zunehmendem Alter wird es weniger) und vom Gewicht (Adipöse haben weniger) konnte aus den PET-CT-Studien berechnet werden, dass – bei sehr hoher Variabilität – etwa 50 Gramm des Kalorien verbrennenden Organs beim erwachsenen Menschen vorhanden sind. Diese Menge ist ausreichend, um bis zu 20 % der täglichen Kalorienzufuhr zu verbrennen. Hochgerechnet auf ein Jahr entspricht das bis zu acht Kilo Körperspeck! Jedoch ist die Aktivität des braunen Fettgewebes nur bei kalten Umgebungstemperaturen induziert, womit wir zur zweiten Frage kommen. In der kalten Jahreszeit sind viele Räume überheizt, jedes Grad zur Erhöhung der Raumtemperatur kostet jedoch bis zu 6 % mehr an Energie. Die Studien zur Aktivierung des braunen Fettgewebes beim Menschen wurden bei 18 °C durchgeführt, also die ideale Raumtemperatur, um im Winter keine überschüssigen Kalorien abzulagern, bereits bestehende Fettpolster abzubauen und einen persönlichen Beitrag zur Reduktion von CO2-Emissionen zu leisten.
Literaturverzeichnis Foto: © Dr. Alexander Bartelt |
L&M 5 / 2011
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |