|
Forscher
>
Prof. Dr. Stephan Becker
>
Neue Strategien für den Umgang mit hochpathogenen Viren
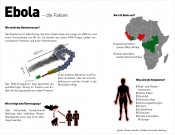
Neue Strategien für den Umgang mit hochpathogenen VirenDer Bedrohung begegnenDerzeit spielt sich vor den Augen der Weltöffentlichkeit in Westafrika eine humanitäre Katastrophe ungeahnten Ausmaßes ab – das Ebolavirus breitet sich in den betroffenen Ländern weiterhin massiv aus, die Sterberate ist auf ca. 70% gestiegen. Einer Prognose der WHO zufolge könnte es bis Dezember 5.000 bis 10.000 neue Ebola-Fälle pro Woche geben. Bei dem Ausbruchsgeschehen handelt es sich um den bislang größten Ebola-Ausbruch. Noch ist das Verbreitungsgebiet der Ebolaviren relativ über- schaubar. Durch die internationalen Flugverbindungen kann ein Krankheitserreger allerdings theoretisch in 24h einmal um die Welt reisen. Der erste in den USA aufgetretene Ebola-Fall mit tödlicher Folge und eine daraus resultierende Ansteckung ist die logische Konsequenz der Reisetätigkeit. Wer das Buch von Richard Preston „The Hot Zone“ von 1994 gelesen hat, in dem es um eine in der Stadt Reston nachgewiesene, nicht pathogene Virusvariante geht, bekommt einen sehr guten Einblick in das Verhalten infizierter Personen und auch, wie damals in den USA der Plan für eine Seuchenbekämpfung aussah – beides sind keine Gründe zur Beruhigung. Im BSL-4-Labor der Philipps-Universität Marburg, einer der führenden Forschungsstellen für Ebola weltweit, wird an den sogenannten importierten Infektionen (Lassa-, Marburg-, Ebolavirus) und hochpathogenen Viren geforscht mit dem Ziel, der tödlichen Gefahr zu begegnen. Claudia Schiller von labor&more war im Gespräch mit Prof. Dr. Stephan Becker, Direktor des Marburger Institutes für Virologie, der seit über 20 Jahren Ebolaviren erforscht. Herr Prof. Becker, wie beurteilen Sie die Notfallpläne für Deutschland, falls ein Ebola-Fall bekannt wird? Sind wir in Deutschland dafür gerüstet, auch eine größere Zahl Infizierter zu behandeln? Zunächst einmal ist eine Einschleppung des Virus nach Deutschland möglich, seine Verbreitung aber sehr unwahrscheinlich. Dennoch sind wir schon seit Langem auf importierte Erkrankungen vorbereitet, weil man sich beispielsweise im Urlaub mit dem Ebolavirus oder auch dem Marburgvirus in afrikanischen Ländern infizieren kann. Die Behörden haben sich deshalb in den letzten Jahren sehr gut darauf vorbereitet. So gibt es an allen großen Flughäfen Pläne für den Umgang mit ankommenden Passagieren mit ersten Symptomen. Grundsätzlich sieht es so aus, dass, wenn ein Ebola-Verdacht besteht, umgehend das Gesundheitsamt benachrichtigt wird, denn es handelt sich um eine meldepflichtige Erkrankung. Wenn sich ein klarer Verdacht ergibt, wird der jeweilige Patient sofort in Quarantäne genommen und es wird unmittelbar eine Diagnostik initiiert. Ist diese positiv, wird der Patient in einer speziellen Sonderisolierstation behandelt. Dort arbeiten Ärzte und Pfleger mit Vollschutz und kommen nicht mit der Luft im Patientenraum in Berührung, sodass die Gefahr einer Ansteckung sehr gering ist. Parallel werden die Kontaktpersonen, mit denen der Patient in Berührung gekommen ist, genau überprüft. Nun hat sich in Spanien eine Schwesternhelferin, die zwei in Madrid behandelte und inzwischen an Ebola verstorbene Missionare gepflegt hat, angesteckt – der erste Fall einer Ansteckung außerhalb Afrikas, dem ein weiterer in den USA folgte. Wie erklären Sie sich das? Es war ein bisschen schwer, das zu verstehen, aber wenn man sich dann doch einmal genauer betrachtet, wie in Spanien gehandelt wurde, dann muss man sagen, dass hier ein deutlicher Unterschied dazu besteht, wie in Deutschland gearbeitet wird, auch, was die Schutzausrüstungen in den Sonderisolierstationen betrifft. Wie zu lesen war, ist diese Schwesternhelferin wohl auch eher dem Hilfspersonal zuzuordnen und demgemäß keine voll ausgebildete Krankenschwester. Hier muss man sich fragen, ob es wirklich Sinn macht, in diesen Fällen Hilfspersonal einzusetzen. Ansteckungen bei der Behandlung Erkrankter, insbesondere wenn der Patient intensivpflichtig ist, sind nicht mit letzter Sicherheit auszuschließen. Das ist wirklich eine herausfordernde Arbeit. Wie groß schätzen Sie vor dem Hintergrund der aktuellen Fälle in den USA und Spanien die Gefahr ein, dass die Ebola-Epidemie außerhalb Westafrikas ausbricht? Ich glaube, hier muss man zwischen Afrika – vor allem Ländern in Zentralafrika, also Gegenden 10° nördlich und südlich des Äquators – und den entwickelten europäischen Ländern sowie den USA ganz deutlich differenzieren. Ich denke, es lässt sich überhaupt nicht vermeiden, dass wir hier Fälle von Ebola bekommen werden, über Personen die ausreisen und erkrankt sind und das gar nicht wissen. Fälle, die in der Inkubationsphase einreisen, können nicht erkannt werden, das ist nicht möglich. Die entscheidende Frage ist, wie wir damit umgehen. Es gilt beim Auftreten von Symptomen sofort zu reagieren, denn die Übertragung findet nur bei symptomatischen Patienten statt, soweit wir das momentan wissen. Ganz wichtig ist hier die Aufmerksamkeit für Ebola und ich glaube, die ist momentan sehr hoch. Vor allem geht es darum, solche Patienten schnell zu erkennen, sie schnell in Quarantäne zu bringen und dann auch schnell zu behandeln. Denn je früher man mit den intensivmedizinischen Ansätzen startet, desto größer ist die Chance der Patienten zu überleben. Ihr Institut ist Konsiliarlabor für Filoviren, den tödlichsten humanpathogenen Viren, zu deren Familie das Ebolavirus gehört. Was ist ihre Besonderheit und was macht sie so gefährlich? Soweit wir das momentan wissen, ist es die Infektion der Zellen des Immunsystems, also der Makrophagen und der dendritischen Zellen, die der erste Anschub dafür sind, dass die Krankheit entgleist. Diese Zellen werden von Filoviren infiziert und reagieren auf eine Art und Weise, mit der der Körper nicht umgehen kann. Es werden dann Botenstoffe in Mengen ausgeschüttet, die vom Immunsystem nicht vertragen werden. Das führt dazu, dass zum einen die Zellen, die für eine adaptive Immunantwort wichtig sind, also T-Zellen und B-Zellen, nicht mehr richtig reagieren und viele davon in Apoptose gehen. Zum anderen können die dendritischen Zellen, deren Aufgabe es ist, T-Zellen und zu stimulieren, ihrer Funktion nicht mehr nachkommen. Durch die Überreaktion des Immunsystems kommt es dann teilweise zu einem Zytokinsturm, der bewirkt, dass die Flüssigkeit nicht mehr in den Blutgefäßen gehalten werden kann und die Blutzufuhr zu den verschiedenen Organen geschmälert wird. Die Blutversorgung wird schlechter, es kommt zu einem Multiorganversagen und schließlich zum Tod des Patienten. Welche Möglichkeiten der Behandlung einer Infektion bestehen derzeit? Wir sind im Moment ausschließlich auf symptomatische Behandlung angewiesen. Es gibt kein zugelassenes Medikament und auch keinen zugelassenen Impfstoff. Es liegen teilweise sehr vielversprechende experimentelle Therapien und Impfstoffe vor und die klinischen Prüfungen hierzu werden in Windeseile nachgeholt. Sie arbeiten in Marburg im Auftrag der WHO an Impfstoffstudien und wollen erstmals im Rahmen des Projektes einen Ebola-Impfstoff am Menschen testen. Zurzeit wird von zwei Vakzinen als Kandidaten für klinische Studien gesprochen. Um welche Vakzine handelt es sich hier, wie aussichtsreich sind sie und wann wird ein Impfstoff frühestens zur Verfügung stehen können? Es gibt im Moment zwei Impfstoffkandidaten, die besonders verfolgt werden. Beides sind Vektorimpfstoffe, d.h., sie basieren auf attenuierten Viren, die beim Menschen keine Erkrankunge auslösen. Bei cAd3-ZEBOV handelt es sich um ein Adenovirus, das normalerweise zu Erkältungskrankheiten führt, bei rVSV-ZEBOV um ein vesikuläres Stomatitisvirus, ein Tierpathogen. In diesen Vektoren ist die genetische Information für das Ebolavirus-Glykoprotein eingebaut. Dieses wird dann in den Zellen des Immunisierten exprimiert und eine Immunantwort gegen Ebola angestoßen. Im Affenmodell war dieser Ansatz zu 100% erfolgreich. Für die Humanstudien wird nun zunächst die Sicherheit des Impfstoffes an einer kleinen Probandenzahl überprüft. Darüber hinaus wird die Immunantwort der Probanden mit der der Affen verglichen. In den klinischen Phasen 2 und 3 kann der Impfstoff dann im Ausbruchsgebiet selbst eingesetzt werden. Der Start der Impfstoffstudie ist Ende Oktober in Hamburg für Deutschland, in Genf für die Schweiz, in Lambarene für Gabun und in Kilifi für Kenia geplant. Es sollte möglich sein, die Daten dann innerhalb von zwei bis drei Monaten auszuwerten und wir hoffen, dann die Entscheidung für eine Fortsetzung in den Phasen 2 und 3 Anfang des kommenden Jahres treffen zu können. Besteht die Hoffnung, dass ein Impfstoff gegen verschiedene Virengattungen wirksam sein wird? Für das adenovirusbasierte Vakzin trifft dies zu, es ist gleichzeitig gegen die Typen Ebola-Zaire und Ebola-Sudan gerichtet, der VSV-Impfstoff ist nur gegen das momentan in Westafrika kursierende Virus gerichtet. Sie haben in früheren Interviews schon beklagt, dass „auf den Ebola-Ausbruch in Westafrika zu spät reagiert wurde“ (radioWelt-Interview Bayern 2). Marburg-Viren sind seit 1967 bekannt, Ebola-Viren seit Ende der 70er-Jahre. Medikamente gibt es bisher nicht. Woran liegt das? Wurde die Gefahr, die von solchen Viren ausgeht, bisher unterschätzt, weil Epidemien immer schnell eingedämmt werden konnten? Da ist relativ einfach zu erklären. In der Tat gibt es diese Viren schon seit 40, 50 Jahren. Es ist aber gleichzeitig so, dass über den gesamten Zeitraum gesehen relativ wenige Menschen daran erkrankt sind. Verglichen mit den Fällen von Malaria, Tuberkulose sowie Durchfallerkrankungen in Afrika und anderen Entwicklungsländern ist das nicht relevant. Der Grund, warum an Ebola und vergleichbaren Viren in nennenswertem Umfang überhaupt geforscht wird und warum im Moment experimentelle Therapien und Impfstoffe überhaupt zur Verfügung stehen, ist, dass in den USA eine große Angst vor Bioterrorismus besteht. Diese flammte 2003 durch die Anthrax-Anschläge nochmals auf und es flossen Millionen in diese Forschung. Impfstoffe und Therapieansätze wurden entwickelt, aber man glaubte nicht, dass man diese auch braucht und die Forschung ging nicht weiter in die klinischen Phasen. Das macht uns gerade zu schaffen. Man muss allerdings sagen, dass ohne diese Bioterrorismusangst die experimentellen Therapien nicht da wären. Der Mensch scheint in immer engeren Kontakt zu Tieren zu geraten, letztlich auch aufgrund der Besiedelung von letzten Rückzugsgebieten der Wildtiere. Ist nicht zu befürchten, dass weitere Viren von Tieren auf den Menschen überspringen werden? Und muss man daher nicht auch mit den am seltensten auftretenden pathogenen Viren zukünftig anders umgehen, zumal viele Viren hohe Mutationsraten aufweisen? Das sehe ich ganz genau so. Wir brauchen eine neue Strategie, wie wir zukünftig mit zoonotischen Erregern umgehen wollen. Das heißt jetzt nicht, dass wir jedes Virus, das neu auftritt, mit Milliardensummen in großem Maßstab erforschen, das wäre sicherlich übertrieben. Aber wir müssen, wenn es zu solchen Ausbrüchen kommt, etwas in der Hand haben, um schnell zu reagieren. Diese Strategien sind erst in Ansätzen zu erkennen. Ich glaube, es muss von der akademischen Forschung und der Ressortforschung in Deutschland eine konzertierte Aktion ausgehen, die das öffentliche Gesundheitssystem und die Ministerien mit einschließt. Abschließend noch eine Frage zu Ihrer zukünftigen Forschung in Marburg: Auf was werden Sie Ihre Schwerpunkte setzen? Eine nicht ganz einfache Frage. Wir werden in jedem Fall weiter vermehrt an solchen Strategien arbeiten, uns also in wachsendem Maße auf solche Ausbrüche vorbereiten. Gleichzeitig müssen wir diese Aktivitäten mit unserem eigenen wissenschaftlichen Interesse kombinieren. Wir werden also die Kombination zwischen Grundlagenforschung an hochpathogenen Viren und der angewandten Forschung verfolgen, um herauszufinden, wie diese Viren zu bekämpfen sind. Wir wollen verstehen, was die Viren so gefährlich macht und auf diesem Verständnis aufbauend Strategien für Medikamente oder Impfstoffe entwickeln. Darüber hinaus wollen wir versuchen, mit vielen anderen Partnern zusammenzuarbeiten, um auf die vermehrt neu auftretenden, aus der Tierwelt eingetragenen Viren und zukünftigen Ausbrüche besser vorbereitet zu sein. „Wir brauchen eine neue Strategie, wie wir zukünftig mit zoonotischen Erregern umgehen wollen. Wir müssen, wenn es zu solchen Ausbrüchen kommt, etwas in der Hand haben, um schnell zu reagieren.“ Herr Prof. Becker, herzlichen Dank für das Gespräch. Bild: © istockphoto.com| Kaprinay |
L&M 9 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |