|
Forscher
>
Dr. Carsten Paul
>
Gegenionenbestimmung in der Pharmaanalytik
Gegenionenbestimmung in der PharmaanalytikLicht aus, Spot anHeute wird ungefähr jede zweite pharmazeutisch aktive Substanz (Active pharmaceutical ingredient API) in ihrer Salzform verabreicht. Der Einsatz der protonierten oder deprotonierten Form der Wirkstoffe und die Wahl der Gegenionen ermöglichen es, wichtige Parameter wie Löslichkeit und Stabilität zielgerichtet variieren zu können. Die Analytik der entsprechenden Gegenionen nimmt einen essenziellen Bestandteil des Entwicklungsprozesses neuer Pharmazeutika ein und ist mittlerweile aus der Qualitätskontrolle dieser Produkte nicht mehr wegzudenken. Bei der Suche nach neuen Wirkstoffen werden immer ausgefeiltere Techniken wie beispielsweise kombinatorische Synthesen verwendet. Abgesehen von den modernen chromatografischen Ansätzen wie z.B. die Ionenchromatografie und HPLC fristete die Gegenionenanalytik ein Schatten- dasein. Häufig sind nicht sehr leistungsstarke Methoden und Techniken im Einsatz. Die HPLC bietet eine moderne, leistungsfähige Alternative durch Optimierung von Separationsbedingungen und Detektionstechnik, um die Gegenionenanalytik effizienter, leistungsstärker und automatisiert – entsprechend dem heutigen Stand der Technik – zu gestalten. Derzeitige Methoden der Gegenionenbestimmung Im Pharmalabor trifft man vornehmlich die potenziometrische Titration oder die Ionenchromatografie (IC) zur Gegenionenbestimmung an. Die Titration ist sehr zeit- und personalintensiv. Die Ionenchromatografie kann mehrere Anionen oder Kationen innerhalb einer Messung analysieren. Allerdings können mit der IC Anionen und Kationen nicht simultan auf einer Trennphase analysiert werden. Spektroskopische Methoden wie die optische Emissionsspektrometrie mit induktiv gekoppeltem Plasma (ICP-OES) oder die Massenspektrometrie mit induktiv gekoppeltem Plasma (ICP-MS) sind Beispiele für hochspezifische Methoden zur Kationenanalytik, bieten aber nur einen eingeschränkten Anwendungsbereich und sind zudem kostenintensiv in der Anschaffung. Insgesamt bietet keine der genannten Methoden die Möglichkeit, eine Vielzahl unterschiedlich geladener Ionen im Rahmen einer Analyse zu messen. Die Ionenchromatografie ist zwar eine leistungsstarke flüssigchromatografische Technik mit spezieller Detektion zur Anionen- oder Kationenanalytik und bereits vielerorts im Einsatz. Allerdings weisen moderne pharmazeutische Formulierungen eine zunehmende Komplexität auf. Diese steigert sich weiter, bezieht man auch den biopharmazeutischen Bereich mit ein. Liegen dann sowohl Kationen als auch Anionen in einer Probe vor, so sind mindestens zwei Trennsätze erforderlich bzw. die Analytik mit der IC ist insgesamt entsprechend aufwändiger. In der Gegenionenanalytik im Pharmabereich fallen typischerweise komplexere Proben an und erfordern eine vielseitige und dennoch einfach zu nutzende Methodik. LC-Trenntechniken zur simultanen Analyse von Anionen, Kationen und anderen Substanzen LC-Methoden beziehen ihr Potenzial zur Auftrennung von Substanzen aus den selektiven Wechselwirkungen der Analytmoleküle mit der stationären Phase, also aus ihrer so genannten Selektivität. Zur Trennung kleiner ionischer Substanzen ist als Trennmechanismus die Ionenaustauschchromatografie unübertroffen. Sie beruht auf der selektiven elektrostatischen Wechselwirkung geladener Analyten mit gegensätzlich geladenen Zentren an der Oberfläche der stationären Phase. Neben den primären Trennmechanismen spielen bei allen LC-Trenntechniken auch Sekundärwechselwirkungen eine entscheidende Rolle für die Selektivität. Der gezielte Einsatz mehrerer verschiedener, in ihrem Beitrag aber nahezu gleichwertiger Mechanismen gewinnt bei der Entwicklung neuartiger Phasen für die LC zunehmend an Bedeutung. Man spricht dabei von so genannten Mixed-Mode-Phasen. Die ersten Säulen dieser Art vereinigten Reversed-Phase (RP)-Mechanismen und Kationen- oder Anionenaustausch. Wenngleich diese Phasen neuartige Selektivitäten bereitstellten und zudem die gleichzeitige Trennung von ionischen und neutralen Substanzen erlaubten, so ließen sie die simultane Retention hydrophiler Kationen und Anionen nicht zu. Kationen- und Anionenaustauschzentren gemeinsam auf einer Phase aufzubringen, funktioniert nur wirksam, wenn eine räumliche Trennung beider Gruppen deren gegenseitige Deaktivierung durch interne Salzbildung verhindert. Durch eine geschickte Synthesetechnik wurde diese Herausforderung mit so genannten trimodalen Phasen erstmalig gemeistert, was durch die schematische Darstellung ihrer Struktur in Abbildung 1 illustriert wird. Diese neuartigen Mixed-Mode-Phasen vereinigen beispielsweise Anionen- und Kationenaustausch mit dem Reversed-Phase Trennmechanismus oder mit der Hydrophylic Interaction Liquid Chromatography (HILIC). Diese trimodalen Phasen erlauben nicht nur die simultane Analyse der positiv und negativ geladenen Gegenionen. Für die meisten Formulierungen der klassischen „Small Molecule Pharma-Welt“ wird hier zusätzlich noch die gleichzeitige Bestimmung der aktiven Substanz ermöglicht. Die universelle Charged- Aerosol-Detektion als neue Chance Um jedoch den Nutzen der vorab beschriebenen trimodalen Trennphasen ausschöpfen zu können, sind herkömmliche Detektionsverfahren ungeeignet. Die überwiegende Mehrzahl der typischen Gegenionen von Wirkstoffen hat kein Chromophor, sodass UV-Detektion ausscheidet. Leitfähigkeitsdetektion ist zwar für solche Gegenionen geeignet, aber weder die Variante ohne Unterdrückung der Grundleitfähigkeit noch die so genannte Suppressor-Technik ermöglicht eine direkte simultane Detektion von Anionen und Kationen. An dieser Stelle kann eine Detektionstechnik ihr Potenzial ausspielen, die allgemein als das universellste Detektionsverfahren in der LC anerkannt ist. Die Charged-Aerosol-Detektion (CAD) beginnt mit einer Verneblung der mobilen Phase, gefolgt von der Erzeugung eines getrockneten Aerosols und anschließender Adsorption von ionisiertem Stickstoff an die getrocknete Partikeloberfläche. Im letzten Schritt wird dann in einem Elektrometer diese Ladung gemessen. Sie ist bei vollständiger Bedeckung der Aerosolpartikel der Oberfläche proportional und damit in erster Näherung auch seiner Masse. Dieses Messprinzip liefert eine äußerst universelle, massenstrom-proportionale Detektion, die organische und anorganische Anionen und Kationen neben neutralen Molekülen simultan erfassen kann. Auf diese Weise können prinzipiell alle nicht flüchtigen oder nur beding flüchtige Bestandteile einer pharmazeutischen Formulierung detektiert werden.
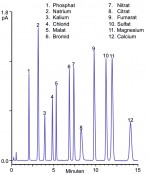
Abb.2 Trennung häufig als pharmazeutische Gegenionen verwendeter Anionen und Kationen an einer Acclaim Trinity P2 Säule und Detektion mit einen Thermo Scientific™ Dionex™ Corona™ Veo™ RS Charged Aerosol Detektor. Eine Komplettlösung zur Gegenionenbestimmung in der modernen Pharmaanalytik und ihre Anwendungen Es liegt auf der Hand, dass die Kombination trimodaler Mixed-Mode-Phasen mit der Charged-Aerosol-Detektion die technischen Werkzeuge für eine solche Lösung darstellen. Komplettiert wird diese technische Lösung durch die entsprechenden vorprogrammierten Analysen-Setups (eWorkflows) im Chromatografiedatensystem, welche mit minimalem Training den schnellsten Weg zum Resultat und Analysenbericht ebnen. Damit ergibt sich eine alle entscheidenden Komponenten und Informationen umfassende Komplettlösung, die selbst dem wenig LC-erfahrenen Anwender einen echten „fliegenden Start“ ermöglicht. Abbildung 2 zeigt den Einsatz dieser kompletten LC-Lösung zur Analyse pharmazeutischer Gegenionen, wobei bei der Entwicklung der verwendeten Trennphase ein besonderes Augenmerk auf die simultane Analyse einwertiger und mehrwertiger Anionen wie Kationen gelegt wurde. In dieser Kombination ist es möglich, sowohl anorganische und organische Anionen als auch einwertige und zweiwertige Kationen innerhalb einer Messung zu separieren und zu detektieren. Insgesamt können somit problemlos zwölf pharmazeutisch relevante Gegenionen innerhalb eines Gradientenlaufs in 15 min analysiert werden. Es soll an dieser Stelle nochmal herausgestellt werden, dass der vorgestellte Ansatz neben dem Screening einer Vielzahl von Gegenionen gleichzeitig die Möglichkeit bietet, auch den aktiven Wirkstoff zu analysieren. Hierbei kann je nach bevorzugtem dritten Retentionsmechanismus zwischen trimodalen Säulen mit Reversed-Phase oder HILIC Retention gewählt werden. Die vorgestellte Lösung aus trimodaler Trennphase und Charged-Aerosol-Detektion lässt sich einfach und unkompliziert erweitern, ohne an Produktivität einzubüßen.
Abb.3 Chromatogramm der Hauptbestandteile des Medikamentes Adderall® (Shire Pharmaceuticals), eine Formulierung zur Behandlung von Konzentrationsstörungen; Saccharin und Amphetamin sind mittels UV-Detektion detektierbar, Aspartat, Natrium und Sulfat durch Charged-Aerosol-Detektion. In Abbildung 3 ist die Trennung der Hauptbestandteile einer kompletten Formulierung gezeigt. Hierbei ist die Analyse flüchtiger Komponenten erforderlich, was mit dem Charged-Aerosol-Detektor nicht bedient werden kann. Aspartat, Natrium und Sulfat werden mit dem Corona Veo CAD detektiert, das leicht flüchtige Amphetamin mit einem in Reihe geschalteten UV-Detektor. Durch diese Vorgehensweise kann ein noch größeres Substanzspektrum genauso schnell und einfach analysiert werden.
Eine sehr anschauliche Darstellung der Funktionsweise des Charged-Aerosol-Detektors finden Sie auf www.thermo |
L&M 8 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |