|
L&M-3-2015
>
Zelluntersuchungen mit der optischen Pinzette revolutionieren die Biomedizin
Zelluntersuchungen mit der optischen Pinzette revolutionieren die BiomedizinGreifen ohne BerührenModernste Mikroskopieverfahren wie die nobelpreisgekrönte STED-Technologie ermöglichen es, Organismen, Zellen, Bakterien bis hin zu Viren, DNA oder einzelne Moleküle mit hoher räumlicher und zeitlicher Auflösung zu untersuchen. Die Chancen zum Eingriff in diese kleinsten biologischen Objekte beschränken sich hingegen größtenteils auf indirekte Methoden. Neue Entwicklungen von Mikropinzetten und mikromechanischen Halterungen sind zwar vielversprechend, doch meist erzeugen sie Veränderungen an den zu untersuchenden Objekten, die aussagekräftige Messungen insbesondere in vivo schwierig machen. Fokussierte Laserstrahlen hingegen, sogenannte optische Pinzetten, ermöglichen es, Zellen und Bakterien berührungsfrei in drei Raumdimensionen zu steuern. Viskoelastizität – essenzielles Merkmal für Gesundheit und Krankheit Viele Prozesse des Lebens beruhen auf einer räumlichen und zeitlichen Interaktion von Proteinen oder Zellen als fundamentale Bausteine. Die Untersuchung dieser Interaktion ist für nahezu alle Bereiche der Krankheitsforschung essenziell, insbesondere für die Infektions- sowie Krebsforschung, und ist eng verbunden mit der Frage der biomechanischen Eigenschaften der Zellen. Viele zelluläre Prozesse hängen von der Viskoelastizität der Zellen und ihrer Umgebung ab. Viskoelastizität ist eine Eigenschaft von Objekten, die sich einerseits elastisch wie Festkörper, z.?B. Gummi, und andererseits viskos wie Flüssigkeiten, z.B. Honig, verhalten. Während der Zellteilung, einer Zellveränderung durch Infektion oder dem Zelltod kann sich die Viskoelastizität von Zellen signifikant verändern. So wird die mit Abstand häufigste Todesursache weltweit, die koronare Herzerkrankung, durch eine Veränderung der Gefäßinnenwand durch Ablagerungen hervorgerufen und führt zu einem Elastizitätsverlust der Gefäße [1, 2]. Der Zusammenhang zwischen zellulären Abläufen und biomechanischen Eigenschaften ist daher ein Schlüssel für die biomedizinische Forschung: Mit dem Wissen über viskoelastische Veränderungen inter- und intrazellulärer Prozesse können aktuelle Krankheiten – darunter auch die Alzheimer Krankheit oder das Wachstum von Tumoren – verstanden und darauf aufbauend Medikamente entwickelt werden. Die Untersuchung viskoelastischer Eigenschaften erfordert die Verformung der Zellen und ihre Messung in Abhängigkeit von der zur Verformung genutzten Kraft. Daher muss ein Verfahren verwendet werden, mit dem man eine Zelle mit einer definierten Kraft beliebig verformen kann. 1970 zeigte Arthur Ashkin, dass es möglich ist, mit Licht Kräfte auf Objekte auszuüben [3]. Die holographische optische Pinzette Bereits Johannes Keppler erkannte am Schweif von Kometen, dass das Licht einen Impuls auf die Staubteilchen des Kometen überträgt, diese beschleunigt und damit den Schweif erzeugt. Der Schweif zeigt weg von der Sonne, also in Ausbreitungsrichtung des Lichtes. Die Kraft, die Objekte in Ausbreitungsrichtung des Lichtes bewegt, wird Streukraft genannt und wächst mit steigender Lichtintensität. Bei transparenten Objekten und nichthomogenen Intensitätsverteilungen tritt zusätzlich die sogenannte Gradientenkraft auf. Diese ist zum Punkt höchster Lichtintensität hin gerichtet. Damit Objekte zu diesem Punkt bewegt werden, muss ein großer Gradient vorhanden sein. Dies kann durch eine Fokussierung des Lichtes erfolgen, wozu typischerweise stark fokussierende Mikroskopobjektive mit hoher numerischer Apertur genutzt werden. Die numerische Apertur beschreibt den halben Öffnungswinkel des austretenden Lichtkegels. Je höher die numerische Apertur, desto größer ist dieser Winkel und damit die Gradientenkraft. Bei ausreichend hoher Lichtintensität übersteigt die Gradientenkraft die Streukraft, sodass transparente Objekte zum Fokuspunkt hin gezogen und dort stabil in drei Raumdimensionen gefangen werden. Im Jahr 1986 entwickelte Arthur Ashkin zusammen mit dem späteren Nobelpreisträger Steven Chu die erste, auf diesem Prinzip beruhende, Gradientenlichtfalle [4], die später als „optische Pinzette“ bekannt wurde. Diese ermöglicht es nicht nur, mit Hilfe eines fokussierten Laserstrahls transparente Objekte zu fangen, sondern sie auch in drei Raumdimensionen zu bewegen. Die Größe der gefangenen Objekte liegt in der Größenordnung von wenigen Mikrometern und ist daher für Zellen und Bakterien ideal geeignet. Eine optische Pinzette wird typischerweise in bestehende Mikroskopieverfahren integriert. Somit können die Objekte gleichzeitig gesteuert und beobachtet werden. Außerdem erfolgt die Steuerung der gefangenen Objekte berührungslos und steril, was für biologische und medizinische Anwendungen einen wesentlichen Vorteil gegenüber herkömmlichen Methoden der Mikromanipulation darstellt. Zur geeigneten Charakterisierung der Steuerung ist es nötig, die Kräfte, die mit der optischen Pinzette erzeugt werden, zu bestimmen. Dazu wird die Position des gefangenen Objektes mit der Fokusposition der optischen Pinzette verglichen. Wirkt keine zusätzliche Kraft auf das Objekt, befindet es sich im Fokuspunkt. Versucht aber z.B. ein Bakterium, sich mithilfe ihrer Flagellen fortzubewegen, so erzeugt ein Bakterium selbst eine Kraft, die der optischen Kraft der Pinzette entgegenwirkt. Dadurch kann es sich geringfügig vom Fokuspunkt entfernen, bleibt aber in der optischen Falle gefangen. Der Abstand vom Fokus zum Bakterium ist proportional zur Kraft, die von dem Bakterium erzeugt wird und ist somit durch Positionsmessungen bestimmbar. Insbesondere erlauben optische Pinzetten, kleinste Kräfte im Bereich von wenigen Piconewton (pN) innerhalb von Zellen oder an Bakterien zu messen. Diese liegen im Bereich der Kräfte, die in einer und um eine Zelle wirken. So erfolgt der Transport von Nährstoffen in einer Zelle durch molekulare Motoren mit einer Kraft von etwa 5pN. Mit der optischen Pinzette ist es möglich, pro Falle nur ein Objekt zu fangen. Zur Bestimmung der Viskoelastizität ist es nötig, eine Zelle festzuhalten und diese zu verformen. Es werden also mehrere Fallen benötigt und diese müssen dynamisch bewegt werden können. Um das zu ermöglichen, verwenden wir holographische Methoden. Hologramme enthalten dreidimensionale Informationen über die Position der Fallen in der Fokusebene. Um das Hologramm dem Laser aufzuprägen, nutzen wir sogenannte räumliche Lichtmodulatoren. Ein Lichtmodulator ist ein Flüssigkristalldisplay, das den Laserstrahl pixelweise modulieren und auf dem ein beliebiges Bild dargestellt werden kann. Die optische Pinzette wird damit zu einer holographischen optischen Pinzette, englisch Holographic Optical Tweezers (HOT). HOT kann durch Modulation eines einzigen Laserstrahls eine Vielzahl an Fallen steuern. Der schematische Aufbau von HOT, integriert in ein Mikroskop, ist in Abbildung 1 dargestellt. Beispiele für typische Hologramme zur Erzeugung von verschiedenen Fallenkonfigurationen sind in Abbildung 2 zu sehen. Damit besitzen wir ein Verfahren, das alle Voraussetzungen zur Charakterisierung der Viskoelastizität – in Bezug auf Krankheiten – erfüllt.
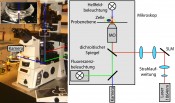
Abb.1 Optische Pinzette, integriert in ein Mikroskop (links). Die Vergrößerung zeigt die Probenebene. Im Mikroskop kann die optische Pinzette mit verschiedenen aktuellen, hochauflösenden Mikroskopieverfahren, z.B. Dunkel- und Hellfeldbeleuchtung, Fluoreszenz-, Konfokal- oder quantitativer Phasenkontrastmikroskopie kombiniert werden. Der Laserstrahl wird über zwei Linsen aufgeweitet und auf den Lichtmodulator abgebildet. Über zwei weitere Linsen wird er auf das Mikroskopobjektiv gelenkt und fokussiert.
Viskoelastizität und Mobilität im Inneren der Zelle Zur Untersuchung der Viskoelastizität von Zellen, Geweben und Blutgefäßen ist es wichtig zu verstehen, wie einzelne Zellbestandteile und -organellen hierzu beitragen. Betrachtet man die Zelle als Ganzes, so ergibt sich die Viskoelastizität als eine Kombination der Einflüsse von Zellmembran, Zellskelett, Zellplasma, aber auch von allen anderen Bestandteilen. Da ein Großteil der biomechanischen Eigenschaften der Zelle vom Zellskelett bestimmt wird, ist dieses von besonderem Interesse [5]. Zur Charakterisierung der Viskoelastizität des Zellskeletts muss das dichte Geflecht von Filamenten in der Zelle gestreckt und verformt werden. Die Deformierung erfolgt auch bei natürlichen Bewegungen von Organellen in der Zelle wie z.B. von Vesikeln. Dazu bringen wir Partikel in das Zellplasma lebendiger Zellen ein. Indem die Partikel mittels HOT in der Zelle bewegt werden, können wir Rückschlüsse auf das Zellskelett treffen und so das Innere der Zelle selbst charakterisieren [5]. Im selben Experiment kann auch die Viskoelastizität der Zellmembran bestimmt werden. Dazu müssen die Partikel innerhalb des Zellplasmas bis zur Zellmembran geführt werden. In Abbildung 3 sind Zellen dargestellt, in denen Partikel von innen gegen die Zellmembran gepresst wurden und diese offensichtlich strecken. In dieser Anwendung wird HOT als holographisch optischer Dehner, engl. stretcher, genutzt. Mit seiner Hilfe sind wir in der Lage, eine Vielzahl von Zellen zu verformen. Dabei wird auch das Zellskelett gestreckt und dessen Einfluss analysiert. Somit ist es möglich, Zellen spezifisch und lokal an mehreren Stellen zu untersuchen und Unterschiede in der Viskoelastizität innerhalb einer Zelle oder einer Gruppe von Zellen zu erkennen. Weiterhin können die Zusammenhänge zwischen zellulären Abläufen und der Viskoelastizität der Zelle untersucht werden. Dies ermöglicht es uns, die biomechanischen Mechanismen von Krankheiten systematisch zu erforschen.
Abb.2 Je nach Hologramm (jeweils obere Zeile) wird eine unterschiedliche Position und Anzahl von Fallen (jeweils untere Zeile) erreicht. Dabei sorgt ein gitterartiges Muster für eine laterale, ein linsenartiges Muster für eine axiale Verschiebung der Falle. Kombiniert man mehrere Gitter und Linsen, so können aus einem Laserstrahl mehrere Fallen erzeugt, dreidimensional angeordnet und zeitlich dynamisch variiert werden. Die Fallen können unabhängig voneinander und gleichzeitig gesteuert werden.
Abb.3 Deformation mehrerer lebendiger Zellen. Mehrere Fallen (weiße Kreise) werden eingesetzt, um die Membranen an mehreren Stellen in verschiedene Richtungen (durch Pfeile dargestellt) zu deformieren, um so lokal die Viskoelastizität zu bestimmen. Je stärker die Deformation, desto elastischer sind die Zellen. Bei vielen Krankheiten werden die Zellen unelastischer. Hier zeigen sich starke Unterschiede in der Dehnbarkeit von Zellen.
Zusammenfassung: ergreifende Möglichkeiten für die Biomedizin Mit HOT ist es möglich, Zellen oder Bakterien mit Licht zu fangen und zu steuern. Zwei grundlegende Kräfte, die Streu- und die Gradientenkraft, sind verantwortlich für die Wirkung des Lichts als optische Falle, in die transparente Objekte hineingezogen werden. Mithilfe eines Lichtmodulators können mehrere solcher Fallen parallel und dynamisch erzeugt werden, um Zellen in drei Raumdimensionen zerstörungsfrei zu bewegen und zu untersuchen. Dadurch ist es möglich, biomechanische Prozesse entweder zu analysieren oder künstlich zu initiieren, in realen Umgebungen zu beobachten und derart einzugreifen, dass neue Erkenntnisse über Krankheitsverläufe erlangt werden. Ihre Anwendung in größeren lebendigen Organismen, die aus mehreren tausenden Zellen bestehen, ist Gegenstand der aktuellen Forschung und wird die Krankheitsforschung revolutionieren.
Literatur Bild: © istockphoto.com|Bara7 |
L&M 3 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |