|
– Wie entstand das Leben? Das extraterrestrische Chiralitätsexperiment der Rosetta-Mission
– Wie entstand das Leben? Das extraterrestrische Chiralitätsexperiment der Rosetta-MissionMolekularer SymmetriebruchDie Entstehung des Lebens auf der Erde ist mit dem stereochemischen Phänomen der Chiralität eng verknüpft. Nachdem am 12. November 2014 die Landefähre Philae des Rosetta-Orbiters auf dem Kometen 67P/Churyumov-Gerasimenko („Chury“) sicher gelandet ist, wurde in der Weltpresse von einem Chiralitätsexperiment berichtet, das auf den möglichen biogenen Ursprung des Lebens im All hinweisen soll. Im vorliegenden Abriss wird versucht, Methodik und Hintergrund der Suche nach homochiralen organischen Stoffen auf einem urzeitlichen Kometen näher zu beleuchten. Was bedeutet eigentlich Chiralität? In der „Prolegomena zu einer jeden künftigen Metaphysik“ stellte Immanuel Kant im Jahre 1783 fest: „Was kann wohl meiner Hand oder meinem Ohr ähnlicher und in allen Stücken gleicher sein, als ihr Bild im Spiegel? Und dennoch kann ich eine solche Hand, als im Spiegel gesehen wird, nicht an die Stelle ihres Urbildes setzen; denn wenn dieses eine rechte Hand war, so ist jene im Spiegel eine linke (sie können nicht kongruieren); der Handschuh der einen Hand kann nicht auf der anderen gebraucht werden.“ Inkongruenz entdeckte Kant auch in spiegelbildlichen „widersinnig gewundenen Schnecken“ (Abb.1). So beträgt das Verhältnis von rechts- zu linksgewendelten Weinbergschnecken 20.000 : 1. Von der Sankha-Muschel, mit der der Hindugott Vishnu abgebildet wird, sind nur wenig linksgängige Exemplare bekannt, die sorgsam in Museen aufbewahrt werden [1].
Abb.1 Schneckenhäuser sind spiralige Gebilde, die rechtsgängig oder auch linksgängig sein können. Die Gehäuse der meisten Schneckenarten sind überwiegend rechtsgängig (Schneckenhaus rechts).
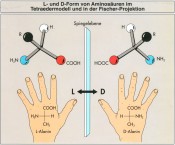
Sir William Thomson (Lord Kelvin) bezeichnete die Eigenschaft der Inkongruenz oder Nichtdeckungsgleichheit von Objekten als „Chiralität“ oder „Händigkeit“ (von griech. cheir = Hand). Er nennt jede geometrische Figur chiral, wenn ihr Bild nicht mit ihrem Spiegelbild zur Deckung gebracht werden kann. Zwei rechte Hände sind homochiral, die rechte und linke Hand sind heterochiral [2]. Chirale Objekte enthalten keine Elemente der Reflexion wie Spiegelebene, Inversionszentrum oder Drehspiegelachse. Anhand von stereoisomeren Weinsäuren entdeckte Louis Pasteur 1848 das Auftreten von Chiralität auch auf molekularer Ebene. Nach den grundlegenden Erkenntnissen von van’t Hoff und Le Bel aus dem Jahre 1875 tritt dreidimensionale Chiralität (Spiegelbildasymmetrie) immer dann auf, wenn der Kohlenstoff als Zentralatom organischer chemischer Verbindungen vier verschiedene Reste in einer tetraedrischen Anordnung aufweist (Abb.2). Die mit L (levo)/D (dextro) oder R (rectus)/S (sinister) spezifizierten inkongruenten spiegelbildlichen Moleküle werden auch als Enantiomere bezeichnet. Enantiomere besitzen in symmetrischer Umgebung die gleichen chemischen und physikalischen Eigenschaften mit Ausnahme des Vorzeichens der optischen Rotation d(+)/ l(–) von linear polarisiertem Licht (Polarimetrie). Wie schon das Beispiel Immanuel Kants impliziert, unterscheiden sich Enantiomere (rechte und linke Hand) jedoch in chiraler Umgebung (rechter Handschuh). Dieser Erkenntnis liegt auch das Prinzip der Trennung von Enantiomeren zugrunde [3].
Abb.2 Inkongruente Spiegelbilder der chiralen Aminosäure Alanin, bei der das zentrale tetraedrische Kohlenstoffatom (nicht eingezeichnet) vier verschiedene Reste trägt (Wasserstoff, Methylgruppe, Aminogruppe und Carboxylgruppe) [3]. Im natürlich vorkommenden L-Alanin steht die Aminogruppe in der Fischer-Projektion (unten links) auf der linken Seite. Genau genommen sind rechte und linke Hände keine echten Enantiomere, sondern Diastereomere, da sie beide nur L-Aminosäuren enthalten (Quelle: Fond der chemischen Industrie).
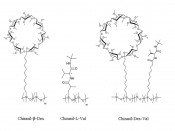
Nachweis von Homochiralität durch Enantiomerentrennung In der belebten Welt auf der Erde, gleichgültig, ob es sich um Viren, Bakterien, Pflanzen, Tiere oder Menschen handelt, treten alle 19 chirale a-Aminosäuren als Bausteine von Eiweißstoffen (Proteine) in der L-Form auf, während Zucker (Monosaccharide) als Bausteine von Nucleinsäuren und Kohlenhydraten ausschließlich in der D-Form vorkommen. Eine Diät, die statt L- nur D-Aminosäuren enthielte, würde durch Mangelernährung letal wirken. Selbst im dritten Millennium ist ungeklärt, wie die Bevorzugung des Bildes vor dem Spiegelbild erfolgte und wieso und auf welche Weise L-Aminosäuren und D-Zucker selektiert wurden [3]. Die Homochiralität ist jedoch eine notwendige Bedingung für die Entstehung des Lebens, wie das folgende Beispiel zeigt [2]. Ein Peptid mit nur drei Aminosäurebausteinen weist bereits 23 stereoisomere Formen auf (LLL, LLD, LDL, LDD/DDD, DDL, DLD, DLL), wenn es aus racemischen D,L-Gemischen aufgebaut wird, während beim alleinigen Vorliegen von L-Aminosäuren nur die eine homochirale Form (LLL) möglich ist. Für Proteine mit n D,L-Aminosäurebausteinen (n bis zu 600) existieren demnach 2n Stereoisomere bzw. nur ein Polypeptid aus L-Aminosäuren. Vor der Entstehung von Lebewesen war also eine Entscheidung zugunsten einer Sorte der Enantiomere (Homochiralität) notwendig. Diese präbiotische „chirale Urzeugung“ mag auf der Erde stattgefunden haben, kann aber grundsätzlich auch durch Kontamination mit enantiomerenangereicherter Materie aus dem Weltraum über Meteoriten zustande kommen. Extraterrestrische Homochiralität im Weltraum kann als Folge der Existenz von zirkular-polarisierter Strahlung oder als Folge der Paritätsverletzung bei der schwachen Wechselwirkung auftreten [4]. Deshalb sind Raumsonden auf dem Weg, um extraterrestrische Homochiralität nachzuweisen. Dazu ist es erforderlich, Enantiomere getrennt identifizieren zu können – eine keinesfalls triviale Herausforderung. Zum Nachweis organischer Kohlenstoffverbindungen im All eignet sich bevorzugt die Gaschromatographie (GC), da sie keine flüssigen Mobilphasen verwendet, einen einfachen schockresistenten Aufbau mit geringem Energiebedarf aufweist, miniaturisiert und problemlos mit der Massenspektrometrie (MS) gekoppelt werden kann. In der GC wird die Innenoberfläche einer Glas- oder Quarzkapillare als Trennsäule mit einer schwerflüchtigen Trennflüssigkeit benetzt und von einem Trägergas (Wasserstoff oder Helium) durchströmt. Unzersetzt flüchtige zur Trennung vorgesehene Komponenten werden im Einspritzblock verdampft und beim Durchgang durch die Trennsäule aufgrund der unterschiedlichen Verteilung zwischen mobiler Gasphase und stationärer Flüssigphase getrennt und anschließend mithilfe eines Detektors in einem Gaschromatogramm identifiziert. Zur Enantiomerentrennung wird nunmehr nach dem Prinzip von Immanuel Kant ein enantiomerenreiner Selektor als chirale Stationärphase eingesetzt (vergleichbar mit dem rechten Handschuh D’), der die Enantiomere in der Mobilphase (vergleichbar mit rechter Hand D und linker Hand L) differenziert aufgrund der in jedem theoretischen Boden der Trennsäule schnell und reversibel ausgebildeten Assoziate DD’ und LD’, die sich energetisch unterscheiden und auch als Diastereomere bezeichnet werden. Die gelungene Enantiomerentrennung erzeugt ein charakteristisches Elutionsprofil aus zwei gleichen gaschromatographischen Signalen, falls eine 1:1-Mischung der Enantiomere D und L, die auch als Racemat bezeichnet wird, vorliegt. Ist ein Enantiomer im Überschuss vorhanden, so ändert sich entsprechend das Signalverhältnis, wodurch die Enantiomerenzusammensetzung präzise bestimmt werden kann [3]. Als chirale Stationärphasen eignen sich in der GC bevorzugt modifizierte Cyclodextrine, die einen chiralen Hohlraum aufweisen, der dem Innern eines leeren Schneckenhauses ähnelt. Enantiomere werden dabei aufgrund eines enantioselektiven Einschlusses getrennt. ß-Cyclodextrin stellt ein cyclisches Oligosaccharid dar, in dem sieben Moleküle der D-Glucose (Traubenzucker) durch a-1,4-Verknüpfung eine zylindrische Struktur (Torus) bilden, die den selektiven molekularen Einschluss von kleinen organischen Verbindungen erlaubt. Bei der in unserer Arbeitsgruppe in Tübingen entwickelten chiralen Stationärphase Chirasil-ß-Dex handelt es sich um permethyliertes ß-Cyclodextrin, das über einen Polymethylen-Anker an Polydimethylsiloxan (Siliconöl) chemisch gebunden ist (Abb.3, links) [5]. Bereit für die Weltraumanalytik Chirasil-ß-Dex lässt sich thermisch auf Quarz- und Silikaoberflächen immobilisieren. Es kann deshalb in allen modernen chromatographischen und elektrophoretischen Methoden als universelle chirale Trennphase in offenen und gepackten Säulen eingesetzt werden („unified enantioselective approach“) [6]. In der GC findet Chirasil-ß-Dex zahlreiche Anwendungen zur Enantiomeranalytik von chiralen Pheromonen, Aromastoffen und Arzneistoffen. Kürzlich wurde Chirasil-ß-Dex für die Korrelation der Absolutkonfiguration von (+)-D-Glycerinaldehyd mit dem ersten realen Abbild eines chiralen Moleküls durch Coulomb-Explosions-Bildgebung herangezogen [7]. Damit ist die oben erwähnte Zuordnung von biogenen Aminosäuren (als L-Enantiomere) und Zucker (als D-Enantiomere) auf der Erde endgültig bewiesen. Ein wichtiger Hinweis auf eine Enantiomerenanreicherung im All wurde gaschromatographisch mit Hilfe von Chirasil-ß-Dex für die nichtproteinogene Aminosäure Isovalin (2-Amino-2-methyl-buttersäure) erbracht, das in einem Verhältnis von 57,6% L zu 42,4% D im Murchison-Meteoriten aufgefunden wurde [8]. Da die D- und L-Enantiomere das gleiche Isotopenmuster aufwiesen, wurde eine terrestrische Kontamination ausgeschlossen. Zur Bestimmung extraterrestrischer Homochiralität auf dem Mars wurden mit Chirasil-ß-Dex belegte Stahlkapillarsäulen (30mm x 0,25mm) für die laufende MSL-Mission (Mars Science Laboratory) und für kommende ExoMars-Missionen (Mars Organic Molecule Analyzer MOMA) ausgewählt [9]. Für kommende Cassini-Huygens-Missionen zum Saturnmond Titan, auf dem Methan und höhere Kohlenwasserstoffe vorkommen, sind dagegen keine chirale GC-Anwendungen bekannt, obwohl racemische unfunktionalisierte Alkane an Chirasil-ß-Dex in die Enantiomere getrennt werden können [3]. Chirasil-ß-Dex ist dagegen für die Clipper-NASA-Mission zum JupitermondEuropa vorgeschlagen worden.
Abb.3 Polymere Chirasil-Stationärphasen zur gaschromatographischenEnantiomerentrennung.
Rosettas Reise zum Kometen Die europäische Raumfahrtbehörde ESA startete mit Giotto und Vega die ersten Weltraummissionen in die Umgebung des Halley'schen Kometen. Für die Rosetta-Mission war zunächst der Komet Wirtanen vorgesehen. Wegen einer technischen Verzögerung mit der Trägerrakete Ariane 5 wurde ein Jahr später am 2. März 2004 der etwa 500 Millionen Kilometer weite Flug zum Komet 67P/Churyumov-Gerasimenko (kurz Chury) gestartet, wobei die Landung nach über zehn Jahren am 12. November 2014 erfolgte. Chury gilt als Überbleibsel aus der Entstehungszeit des Sonnensystems vor 4,6 Mrd. Jahren und kann somit für Bioastronomen als Abbild der primordialen Erde dienen. Rosetta besteht aus den beiden Komponenten Rosetta-Orbiter und Philae-Landesystem [10]. Zur Bestimmung der Präsenz von organischen Verbindungen enthält Philae ein Pyrolyse-GC-Flugzeit-Massenspektrometer als Teil des COSAC-Experiments (COmetary SAmpling and Composition). Das miniaturisierte COSAC-Instrument enthält acht Quarzkapillarsäulen, wobei zwei davon die polymeren chiralen Stationärphasen Chirasil-L-Val (Abb.3, Mitte) für enantiomere Aminosäuren und Chirasil-ß-Dex (Abb. 3, links) für chirale Kohlenwasserstoffe und Alkohole enthalten [10]. Nach erfolgter Landung von Philae werden im Probenbohr- und Probenverteilungssystem Stichproben extrahiert und organische Komponenten wahlweise in zwei Pyrolyseöfen mit 600°C und 180°C in die Gasphase überführt. Für Hydroxycarbonsäuren und für zwitterionische Aminosäuren ist ein einstufiger Derivatisierungsschritt zur Überführung in flüchtige Abkömmlinge notwendig. Dies geschieht durch Reaktion mit DMF-DMA (N,N-Dimethylformamid/O,O-Dimethylacetal). Eine quantitative Enantiomerentrennung gelingt dabei allerdings nur für Valin, Isoleucin, Asparaginsäure und Phenylalanin. Aufgrund der hohen Trennschärfe der Hochleistungs-GC unter Verwendung von Quarzkapillarsäulen (10m x 0,25mm x 0,25m Stationärphase, Abb.4) sollte die erwartete Multikomponenten-Analyse kein Problem darstellen.
Abb.4 Mit Chirasil-Phase belegte Quarzkapillarsäule mit Heizung und Wärmeleitfähigkeitsdetektor im COSAC-Instrument des Philae-Landungssystems an Bord von Rosetta [10].
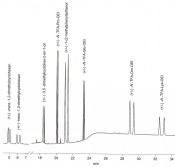
Nach der erfolgten Landung von Philae wurden Messungen an der Chirasil-ß-Dex-Säule zunächst ohne Derivatisierung durchgeführt, deren Ergebnisse der Öffentlichkeit noch nicht zugänglich sind. Weitere Messungen sind erst möglich, wenn die Batterie der zurzeit schlummernden und offenbar in schattiger Position gelandeten Philae bei höherem Sonnenstand aufgeladen werden kann. Für künftige Anwendungen eignet sich die kombinierte chirale Stationärphase Chirasil-Dex-Val (Abb.3, rechts), die gleichzeitig chirale Kohlenwasserstoffe, Alkohole, Ketone und derivatisierte Aminosäuren in die Enantiomere trennt (Abb.5) [11].
Abb.5 Simultane gaschromatographische Enantiomerentrennung (Signalverhältnis 1:1) von Cycloalkanen, einem Keton, einem Alkohol und den ?-Aminosäuren Prolin, Glutaminsäure, Ornithin und Lysin (als N-Trifluoracetyl-O-Ethylester) an Chirasil-Dex-Val mit einer Quarzkapillare (20?m x 0.25?mm x 0.25??m Schichtdicke) im Temperaturprogramm und mit Wasserstoff als Trägergas [11].
Inwieweit das Chiralitätsexperiment im weiten All auf dem Kometen Chury gelingt, steht sprichwörtlich in den Sternen. Der hohe Anspruch der Namensgebung Rosetta und Philae für die erfolgreiche Entzifferung der Hieroglyphenschrift durch J. F. Champollion im Jahre 1822 täuscht nicht darüber hinweg, dass das Rätsel der Entschlüsselung der Entstehung des Lebens und des damit einhergehenden molekularen Symmetriebruchs nur sehr schwer zu lösen sein wird.
Literatur Bild: © istockphoto.com| knape |
L&M 5 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |