|
Pharma
 >
Bakterielle Infektion auf Rezept
>
Bakterielle Infektion auf Rezept
Bakterielle Infektion auf RezeptWie pathogene Bakterien im Kampf gegen Krebs zu nützlichen Helfern werden können
Einen Patienten mit einem soliden Tumor absichtlich mit Bakterien infizieren?
Auf den ersten Blick wirkt die Idee durchaus etwas absurd, Krebs mithilfe einer Bakterieninfektion zu heilen. Sie geht jedoch zurück auf eine Beobachtung, die bereits Anfang des 19. Jahrhunderts gemacht wurde. Spontane Rückgänge von Krebsgeschwüren wurden und werden immer wieder beobachtet. Vaultier erkannte allerdings, dass es einen Zusammenhang zwischen manchen „Spontanheilungen“ und der Tatsache gab, dass diese Patienten an Gasgangrän litten [1]. Viele Bakterien können Tumore kolonisieren
In der Zwischenzeit wissen wir wesentlich mehr über Bakterien, das Immunsystem und über zu Grunde liegende molekulare Mechanismen der Wirt-Pathogen-Wechselwirkung. Jetzt sollte es möglich sein, die ursprünglichen Probleme der bakteriellen Infektion zu kontrollieren. Entsprechend wird seit einigen Jahren wieder intensiv an der bakterienvermittelten Krebstherapie geforscht und für viele verschiedene Keime konnte gezeigt werden, dass sie nach systemischer Verabreichung selbstständig in Tumore einwandern und sich dort vermehren. Teilweise führt die Besiedelung dazu, dass der Tumor sein Wachstum einschränkt oder zurückgedrängt wird. Dies gilt für obligat anaerobe Bakterien wie Clostridien oder Bifidobakterien, aber auch für fakultativ anaerobe wie Salmonellen oder E. coli. Die Betonung der Lebensweise ist deshalb relevant, weil die meisten größeren Tumore Regionen aufweisen, die schlecht mit Blut versorgt werden und in denen deshalb ein niedriger Sauerstoffpartialdruck herrscht. Dort sterben die Tumorzellen ab und es bilden sich Nekrosen. Die Herausforderung einer sicheren bakterienvermittelten Tumortherapie Für eine klinische Anwendung spielt zunächst einmal die Sicherheit des Therapieansatzes eine entscheidende Rolle. Deshalb ist die Abschwächung der bakteriellen Pathogenität durch entsprechende Mutationen esnziell. Ein Beispiel für eine solche Mutante, ist der häufig verwendete S. typhimurium Sicherheitsstamm VNP20009, mit dem bereits zwei klinische Studien durchgeführt wurden, allerdings mit geringem Erfolg. Die Tumore der Patienten wurden kaum oder gar nicht kolonisiert [3,4]. Bei VNP20009 ist das Lipopolysaccharid in der Außenmembran verkürzt. Dies führt nach einer Infektion im Vergleich zum Wildtypstamm zu einer dramatisch verringerten Ausschüttung des Zytokins TNF und somit zu einer wesentlichen Reduktion der Gefahr eines toxischen Schocks. Wir konnten in der Zwischenzeit jedoch zeigen, dass TNF eine maßgebliche Rolle bei der Besiedelung des Tumors spielt [5]. Somit ist nun die offensichtliche Herausforderung, ein Bakterium zu konstruieren, das ausreichend pathogen ist, um erfolgreich Tumore zu besiedeln und zu bekämpfen, dabei aber möglichst geringe toxische Nebenwirkungen auslöst. Gezielte Expression von therapeutischen Stoffen – Bakterien als Transporter
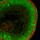
Mit wenigen Ausnahmen reicht die Besiedelung von Tumoren mit abgeschwächten Bakterien nicht aus, um den Tumor komplett zu entfernen. Die Mikroorganismen können aber als Transporter für therapeutisch wirksame Stoffe verwendet werden. Solche Moleküle könnten zum Beispiel bakterielle Toxine oder „pro-drug converting enzymes“ sein, die Vorstufen in toxische Substanzen umwandeln, aber auch Zytokine. Um zu verhindern, dass diese Moleküle nicht bereits auf dem Weg der Bakterien zum Tumor oder in gesunden Organen Schaden anrichten, ist es wichtig, die Expression dieser Moleküle auf das Tumorgewebe zu beschränken. Dazu können bakterielle Promotoren genutzt werden, die Genexpression ausschließlich im Tumorgewebe gewährleisten. Zur Definition derartiger Promotoren haben wir zwei komplementäre Methoden verwendet. Einerseits wurde eine so genannte „promotor-traplibrary“ untersucht. Sie besteht aus transformierten Salmonellen, die Expressionsplasmide besitzen, auf denen zufällige Stücke des Salmonellengenoms einen GFP-Reporter kontrollieren. Werden tumortragende Mäuse mit derartigen Bakterien infiziert, können durch mehrere positive und negative Selektionsschritte Transformanten heraussortiert werden, die den GFP–Reporter ausschließlich im Tumor exprimieren. Sequenzieren der Plasmide führte bisher zur Definition von 14 regulatorischen Genomsequenzen, die eine tumorspezifische Genexpression ermöglichen (Abb. 2).
sara.leschner@helmholtz-hzi.de
Abb. 1: Schematische Darstellung der Genexpressionsanalyse. Normale und tumortragende Mäuse werden intravenös mit Salmonellen infiziert.
Abb. 2: Tumorspezifische Expression. Durchflusszytometrische Analyse von Tumor-, Milzund Lebergewebe einer Maus, die zuvor mit einem als tumorspezifisch definierten Klon der „promoter-trap-library“ infiziert wurde. Um das GFP-Signal von der Autofluoreszenz des Wirtsgewebes unterscheiden zu können, wird die Fluoreszenzintensität (dargestellt in einer willkürlichen Einheit) des grünen Kanals (FL-1) gegen den orangefarbenen (FL-2) Kanal gemessen. Die Unterscheidung ist möglich, da
Literatur |
L&M 5 / 2010
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |