|
Chemie
 >
Forschung & Entwicklung
>
Forschung & Entwicklung
 >
Synthesechemie: Englerin A ein selektiver Wachstums-Inhibitor gegen mehrere Nierenkrebszell-Linien
>
Synthesechemie: Englerin A ein selektiver Wachstums-Inhibitor gegen mehrere Nierenkrebszell-Linien
Synthesechemie: Englerin A ein selektiver Wachstums-Inhibitor gegen mehrere Nierenkrebszell-LinienOrganische Chemie als „Enabling Science“
Prof. Dr. Mathias Christmann, Dr. Matthieu Willot, Dipl. Chem. Lea Radtke Lehrbereich Organische Chemie, Technische Universität Dortmund Abb.: Molekulare Oberfläche (transparent) über dem Molekülgerüst von Englerin A. Die Oberfläche ist entsprechend dem elektrostatischen Potenzial eingefärbt. Die farbigen Kegel symbolisieren das elektrische Feld. Im Januar 2009 berichtete eine Arbeitsgruppe am National Cancer Institute (Fredrick, USA), dass ein Extrakt der afrikanischen Pflanze Phyllanthus Engleri selektiv toxisch auf Nierenkrebs-Zelllinien wirkt. In einigen Fällen übertrifft Englerin A sogar die Wirkung von Paclitaxel (Taxol®). Das Team um John A. Beutler konnte den für die Toxizität verantwortlichen Wirkstoff identifizieren und seine Struktur mit Ausnahme der absoluten Konfiguration bestimmen [1]. Ohne Kenntnis der absoluten Konfiguration gleicht die Aufgabe der Herstellung eines Schuhs für einen Einbeinigen, von dessen Fuß man alle Maße mit großer Exaktheit kennt – aber in Unkenntnis bleibt, ob es sich um einen rechten oder linken Fuß handelt. Aufgrund der interessanten biologischen Eigenschaften von Englerin begann nach der Veröffentlichung ein internationaler Wettlauf um die erste Herstellung im Labor (Totalsynthese). Im Gegensatz zur Isolierung aus Pflanzen, Pilzen oder Bakterien hat die Synthese von Naturstoffen mehrere Vorteile: Zum einen ist es oft die einzige Möglichkeit, größere Mengen der Verbindung für Tests zur Verfügung zu stellen. Zum anderen kann der Wirkstoff so für die spezielle Anwendung optimiert werden. Beim „Nachbau“ von Naturstoffen können die Chemiker sich direkter auf die gewünschte Wirkung auf den Menschen konzentrieren – die Naturstoffe selbst lassen sich nur teilweise in ihrer Struktur verändern.
Abb.: Ein retrosynhetischer Schnitt am Beispiel der Ringöffnung: Die hervorgehobene C-O-Bindung der Verbindung A soll gespalten werden. Das Bindungselektronenpaar wird dem elektronegativeren Sauerstoff zugeordnet, am Kohlenstoff verbleibt eine positive Ladung (Ladungsneutralität). Es entsteht formal die nicht-stabile Verbindung B, welche in eine stabile Verbindung C überführt, deren Reakivität aber der Verbindung B entspricht. Dieses Verfahren, die sogenannte Retrosynthese, wird iterativ durchgeführt bis schließlich eine bekannte Verbindung erhalten wird.
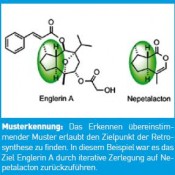
Ein nachwachsender Rohstoff hat es in sich In unserer Arbeitsgruppe begannen wir im März 2009 mit den Untersuchungen zur Herstellung von Englerin im Labor. Durch den Vergleich von Englerin A mit anderen Naturstoffen konnte eine teilweise Überlappung der Englerin-Struktur mit einem Inhaltsstoff aus dem Öl der Katzenminze gefunden werden [2]. Der psychoaktive Inhaltsstoff (Nepetalacton) des Öls der Katzenminze (Nepeta Cataria) kann bei Katzen rauschhafte Erregungszustände auslösen. Nepetalacton ist ein so genannter nachwachsender Rohstoff, das heißt, er kann im Gegensatz zu fossilen Rohstoffen durch Isolierung aus der Katzenminze immer wieder neu gewonnen werden. Die Herstellung von Feinchemikalien und Wirkstoffen aus nachwachsenden Rohstoffen hat in jüngster Zeit stark an Bedeutung gewonnen, da Produktionsabläufe immer häufiger auf den Aspekt der Nachhaltigkeit geprüft werden. Vom Startmaterial zur absoluten Konfiguration Bevor man im Labor mit der Synthese beginnen kann, ist es erforderlich, einen flexiblen Syntheseplan zu entwerfen, der dem groben Verlauf der Synthese entspricht. Dazu wendet man das Verfahren der Retrosynthese an. In diesem gedanklichen Prozess werden so Bindungen im Zielmolekül gebrochen, wodurch sich die Komplexität des Moleküls schrittweise verringert, bis man das gewünschte Startmaterial oder eine andere bekannte Ausgangsverbindung erhält. Wie beim Bergsteigen ist auch hier nicht immer der direkte Weg der schnellste. Die Planungsphase einer Synthese ist jedoch essenziell für eine rasche Durchführung. In nur sechs Monaten gelang es unserem Team, ausgehend von Nepetalacton die Synthese von Englerin abzuschließen. Mit der ersten Synthese konnte durch Vergleich der optischen Drehung des polarisierten Lichts auch die bisher unbekannte absolute Konfiguration von Englerin A bestimmt werden. Dabei stellte sich heraus, dass das Enantiomer („der falsche Schuh“) von Englerin A hergestellt worden war. Das nächste Ziel ist jetzt die Herstellung des natürlichen Enantiomers von Englerin A in Mengen, die weiterführende biologische Studien und mögliche Anwendung in der Medizin vorantreiben sollen. Hierfür wird eine enge Zusammenarbeit mit den Kollegen vom National Cancer Institute, aber auch mit Arbeitsgruppen in Dortmund am Max-Planck-Institut für Molekulare Physiologie erfolgen. Die nächsten Schritte sind die Untersuchung des Einflusses von strukturellen Veränderungen von Englerin auf dessen biologische Aktivität und die Aufklärung des Wirkmechanismus auf molekularer Ebene. Um das letztgenannte Ziel zu erreichen, ist es erforderlich, die Moleküle (z.B. Proteine) innerhalb der Zelle zu identifizieren, mit denen Englerin A in Wechselwirkung tritt.
Abb.: Musterkennung: Das Erkenn überstimmender Muster erlaubt den Zielpunkt der Retrosynthese zu finden. In diesem Beispiel war es das Ziel Englerin A durch iterative Zerlegung auf Nepetalacton zurückzuführen.
Flaschenhals für die Entwicklung neuer Wirkstoffe
Mit der ersten Synthese wurde der Grundstein für weiterführende Forschungsarbeiten mit dem Fernziel einer medizinischen Anwendung gelegt. Bis zu einer ersten klinischen Anwendung werden aber noch viele Jahre vergehen. Zunächst muss die Frage geklärt werden, warum Englerin A selektiv Nierenkrebszellen tötet und wie sich die Verbindung gegenüber normalen Körperzellen verhält. Die Synthesechemie kann hier einen Beitrag zur medizinischen Forschung leisten. Oft stehen grundlegende Arbeiten der Chemie im Schatten ihrer Anwendung in der Medizin oder den Biowissenschaften.
Quelle: Prof. Dr. Thomas Exner, Universität Konstanz |
L&M 2 / 2010
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |