|
Chemie
 >
Das angeborene Immunsystem erkennt Viren an tri- und diphosphorylierter doppelsträngiger RNA
>
Das angeborene Immunsystem erkennt Viren an tri- und diphosphorylierter doppelsträngiger RNA
Das angeborene Immunsystem erkennt Viren an tri- und diphosphorylierter doppelsträngiger RNAViren in der ZangeDer Immunrezeptor RIG-I erkennt RNA-Viren durch Detektion ungewöhnlicher Strukturen und Modifikationen viraler RNA und initiiert eine potente antivirale Immunantwort. Wir haben den Mechanismus der Virus-RNA-Erkennung durch RIG-I entschlüsselt. Unsere neuesten Untersuchungen zeigen, dass RNA-Viren fast kein Spielraum bleibt, der Immunerkennung zu entkommen, da RIG-I alle bekannten, natürlich vorkommenden virusspezifischen RNA-Modifikationen detektieren kann. Fremdartige Komponenten in Pathogenen Unter dem angeborenen Immunsystem versteht man alle Mechanismen und Zellen des Immunsystems, die unmittelbar, also naiv, in der Lage sind, Krankheitserreger als solche zu erkennen und zu bekämpfen. Immunrezeptoren des angeborenen Immunsystems erkennen eindringende Krankheitserreger, sogenannte Pathogene, wie z.B. Parasiten, Pilze, Bakterien oder Viren anhand pathogenspezifischer Strukturen (Abb.1). Dazu gehören häufig Bestandteile strukturgebender Komponenten – z.B. aus der Zellwand – wie besondere Proteine, Zuckerpolymere oder Lipide (Abb.1). Bei Erkennung pathogener Strukturen lösen diese Immunrezeptoren unmittelbar eine Kaskade von Signalen in der Zelle aus, die zur Ausschüttung von Botenstoffen (Interferone, Zytokine, Chemokine) führen, um Nachbarzellen in einen alarmierten Zustand zu versetzen und Immunzellen anzulocken und zu aktivieren. Außerdem können in der befallenen Zelle selbst Mechanismen aktiviert werden, die es zum Ziel haben, den eingedrungenen Organismus – notfalls durch programmierten Zelltod – zu eliminieren. Die Aktivierung des angeborenen Immunsystems ist die Voraussetzung für die Initiation der sogenannten adaptiven oder „angelernten” Immunantwort mit Ausbildung eines Immungedächtnisses, wie man es von der Impfung kennt. Hier entstehen hoch spezialisierte Immunzellen, sogenannte T- und B-Lymphozyten, die spezifisch bestimmte Proteine der Erreger oder mit diesen Erregern infizierte Zellen sofort erkennen und Antikörper bilden, die die Erreger bei erneuter Infektion markieren oder neutralisieren können.
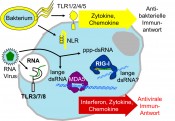
Abb.1 Rezeptoren des angeborenen Immunsystems: Toll-like-Rezeptoren (TLRs) auf der Zelloberfläche und NOD-like-Rezeptoren (NLRs) im Zytosol detektieren Komponenten der bakteriellen Zellwand oder des Bewegungsapparates (Flagellin) und induzieren proinflammatorische antibakterielle Signale. TLRs im Endosom erkennen einzel- und doppelsträngige RNA, die zytosolischen Rezeptoren MDA5 und RIG-I erkennen lange doppelsträngige und kurze doppelsträngige RNA mit besonderer 5’-Modifikation. Die Stimulation der Nukleinsäurerezeptoren initiiert eine Interferon-dominierte antivirale Immunantwort.
RIG-I und MDA5 teilen sich die Aufgabe Ein besonderer Krankheitserreger, die sogenannten Viren, haben keinen eigenen Stoffwechsel und bestehen hauptsächlich aus einem DNA- oder RNA-Genom, das in Proteinen und Lipiden verpackt ist. Das Genom enthält den Bauplan für Proteine, die das Virus für seine Vermehrung benötigt. Da Viren keine selbstständigen Organismen sind, benutzen sie den Biosyntheseapparat der Wirtszelle, um sich zu replizieren. Dadurch entstehen kaum fremdartige Moleküle wie z.B. aus Bakterien, die das Immunsystem leicht als krankheitserregend erkennen kann. So erkennen antivirale Immunrezeptoren das, woraus das Virus vor allem besteht: aus den Nukleinsäuremolekülen des viralen Genoms. Das Genom eines Virus kann aus DNA (wie beim Menschen) oder aus RNA bestehen. DNA-Genom-basierte Viren wie Herpesviren können nach akuter Infektion lebenslang inaktiv im Körper vorhanden sein, weil sich das virale DNA-Genom sehr leicht zusammen mit dem körpereigenen DNA-Genom im Zellkern der Wirtszelle „verstecken“ kann. Im Gegensatz dazu lösen RNA-basierte Viren während ihres Aufenthaltes in der Wirtszelle meistens heftige Immunreaktionen aus, die von erheblichen Krankheitssymptomen begleitet werden. RNA-Viren verursachen Erkältungskrankheiten wie Schnupfen und grippale Infekte (Rhino-, Entero-, Corona-, -Viren), Grippe (Influenza-Virus), Erkrankungen des Magen-Darm-Traktes (Noro-, Reovirus) und können auch hämorrhagisches Fieber auslösen (Gelbfieber-, Dengue-, Lassa-, Ebola-Virus). Das angeborene Immunsystem verfügt über Rezeptoren, die virale von endogener RNA unterscheiden können (Abb.1). Dabei wird virale RNA als solche z.B. dadurch erkannt, dass sie sich am falschen Ort befindet, also nicht im Zytosol oder im Zellkern: So detektieren Toll-like-Rezeptoren (TLR3 und TLR7) RNA im Endosom. Im Zytosol wird die Unterscheidung schwieriger, da Rezeptoren des angeborenen Immunsystems hier wenige virale RNA-Kopien im Hintergrund der im Überfluss vorhandenen zellulären mRNAs, t-RNAs und ribosomalen RNAs entdecken müssen. Die sich komplementierenden RNA-Rezeptoren RIG-I und MDA5 im Zytosol sind essenziell für die antivirale Immunantwort gegen alle bekannten RNA-Viren (Abb.2) [1]. Diese Rezeptoren erkennen virale RNA anhand ihrer ungewöhnlicher Struktur oder Modifikation. In den hier beschrieben Arbeiten unseres Labors geht es um die Untersuchung des Mechanismus, mit dem RIG-I virale RNA erkennt.
Abb.2 Viruserkennung – RIG-I und MDA5 teilen sich die Aufgabe: RIG-I und MDA5 erkennen alle bekannten Arten von Viren mit Ausnahme einzelner Stämme (unten rechts). Die aufgeführten RNA-Strukturen werden als die entscheidenden RIG-I/MDA5-Liganden vermutet und wurden z.T. auch bestätigt.
Erkennung viraler RNA RIG-I spielt im humanen System und bei vielen anderen Wirbeltieren (ausgenommen dem Huhn) für die Abwehr der meisten stark pathogenen RNA-Viren (wie z.B. Influenza, Gelbfieber, Dengue-Virus, Ebola) eine zentrale Rolle (Abb.2) [1]. Im Gegensatz zu den meisten Rezeptoren des angeborenen Immunsystems, die sich oft nur in Immunzellen befinden, ist RIG-I in allen bekannten Zelltypen vorhanden. Dabei erkennt RIG-I nach bisherigen Erkenntnissen die genomische RNA des Virus, jedoch nicht die virale mRNA, die strukturell mit der mRNA der Wirtszelle identisch ist. Die genomische virale RNA unterscheidet sich von mRNA oder ribosomaler RNA (rRNA) hinsichtlich Struktur und chemischer Modifikation: Anders als bei der mRNA, die als RNA-Einzelstrang vorliegt, kommt es bei der Replikation des Virus entweder zur Bildung von doppelsträngigen replikativen RNA-Genom-Zwischenstufen (z.B. bei Gelbfieber oder Dengue-Viren) oder es entstehen doppelsträngige RNA-Genome (z.B. bei Reoviren) oder RNA-Duplex-Bereiche durch terminale selbstkomplementäre Bereiche genomischer RNA (z.B. Influenza- oder Ebola-Viren) (Abb.2) [1]. Indem wir die entscheidenden Strukturen viraler RNA nachbauten, konnten wir nachweisen, dass RIG-I basengepaarte RNA erkennt, wenn diese mit einer unmodifizierten 5’terminalen Triphosphatgruppe versehen ist (Abb.3) [2,3]. Dabei war eine Basenpaarung des 5’triphosphorylierten (ppp) terminalen Nukleotids essentiell für die Aktivierung von RIG-I [3]. Da bei jeder RNA-Virus-Genom-Replikation, bei der RNA als Matrize für die RNA-Kopie dient, eine solche terminale Struktur entstehen muss, handelt es sich hier um ein für RNA-Viren unvermeidbares Erkennungsmotiv, das durch RIG-I detektiert wird. Eine solche Struktur kann prinzipiell nicht in der Wirtszelle entstehen: Obwohl auch bei der Synthese endogener RNA im Zellkern zunächst pppRNA entsteht, so wird die ppp-Gruppe jedoch entweder abgespalten (rRNA) oder so modifiziert (sogenanntes Capping bei mRNA), dass RIG-I die ppp-Gruppe nicht mehr erkennt [2]. Zudem können weitere interne RNA-Modifikationen in mRNA, t-RNA und rRNA (z.B. 2’O-Methylierung) die Erkennung durch RIG-I verhindern [2]. Hinzu kommt, dass für die endogene RNA der Wirtszelle die genomische DNA als Matrize für die RNA-Transkription dient, sodass keine perfekt doppelsträngige RNA entsteht. Durch Röntgenstrukturanalyse von Komplexen aus RIG-I und synthetischer pppRNA konnten wir aufklären, wie die genannten Erkennungskriterien zustande kommen [4]: Eine basische Bindungstasche bindet die ppp-Gruppe und Teile des RNA-Rückgrates der RNA-Helixstruktur, während eine aromatische Seitengruppe für die Erkennung des terminalen Basenpaares verantwortlich ist [4] (Abb.3).
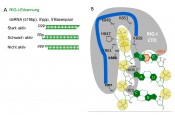
Abb.3 Das RIG-I Erkennungsmotiv: A: Strukturabhängige RIG-I-aktivierende Wirkung von pppRNA. B: Schema der Interaktion von doppelsträngiger pppRNA mit den Aminosäuren der RNA-Bindungstasche (CTD) von RIG-I. pppRNA: Phosphate: gelb, RNA-basen und Riboserückgrat: grün. Das terminale ppp und ein Rückgrat-Phosphat binden in der basischen Bindungstasche, die aus Lysin (K) und Histidin (H)-Seitenketten besteht. Ein Phenylalanin bindet spezifisch ein basengepaartes 5’-Ende. Die basische Bindungstasche zusammen mit dem Phenylalanin vermitteln das Erkennungsmotivs von RIG-I (triphosphorylierte basengepaarte RNA).
Es gibt kein Entkommen Viren haben unterschiedliche Mechanismen entwickelt, dem angeborenen Immunsystem zu entkommen. Neben viralen Proteinen, die die Rezeptoren und nachgeschaltete Signalwege blockieren, modifizieren manche Viren mit sehr großem Aufwand die Struktur oder Modifikation ihrer genomischen RNA, sodass erst gar keine Erkennung stattfindet: Dazu gehört beispielsweise die Abspaltung des 5’terminalen Nukleotids (Borna-/Bunyavirus [5]) oder die Generierung von 5’Überhängen (Bunyavirus [6]). Ein bisher ungelöstes Phänomen war, wie Reo-Viren, Verursacher von Durchfallerkrankungen, durch RIG-I erkannt werden. Die Segmente des linear doppelsträngigen Genoms von Reo-Viren trägt an seinen 5’Enden auf der einen Seite eine mRNA Cap-Struktur und auf der anderen Seite eine 5’Diphoshatgruppe. Dabei verfügt das Reo-Virus über ein virales Capping-Enzym, das aus pppRNA gecappte RNA mit mRNA-Struktur machen kann. Der erste Schritt bei der Umwandlung von pppRNA zu Cap-RNA ist die Dephosphorylierung zu ppRNA. Danach erfolgen die Umsetzung mit GTP zu GpppRNA und weitere Modifikationen. Vermutlich entsteht der diphosphorylierte Strang des Reo-Virus-RNA-Genoms durch einen unvollständigen Capping-Prozess. Die Tatsache, dass genomische Reo-Virus-RNA trotz Fehlen von freien 5’ppp–Gruppen durch RIG-I erkannt wird, warf nun die Frage auf, was der dahinterstehende Mechanismus ist. Bisherige Studien hatten darauf hingedeutet, dass RIG-I auch sehr lange dsRNA – unabhängig von 5’ppp – erkennen kann. Um den Einfluss der terminalen pp-Gruppe zu überprüfen, isolierten wir genomische Reo-Virus-RNA und spalteten die 5’pp-Gruppen durch Einwirken des Enzyms alkalische Phosphatase ab [7] (Abb.4). Für uns überraschend verlor die genomische RNA dadurch fast ihre gesamte RIG-I-aktivierende Wirkung. Dies konnte entweder daran liegen, dass die virale Umwandlung von ppp zu pp nicht vollständig genug abläuft und einige Genomsegmente 5’ppp-Gruppen tragen oder dass auch eine 5’pp-Gruppe ausreicht, um RIG-I zu stimulieren. Die Herstellung und Testung von synthetischer ppRNA lieferte schnell den Beweis, dass auch die 5’pp-Gruppe, wenn auch um ca. 70% vermindert, grundsätzlich in der Lage ist, RIG-I zu stimulieren (Abb.5). Die massenspektroskopische Analyse der 5’Enden und ein neu entwickeltes Analyseverfahren, das auf selektivem Verdau von ppRNA gegenüber pppRNA beruht, bestätigten, dass im Reo-Virus-RNA-Genom lediglich 5’pp-Gruppen, jedoch keine freien 5’ppp-Gruppen vorhanden sind [7]. Dies bedeutet schließlich, dass RIG-I das Reo-Virus-Genom über die Interaktion mit den freien 5’pp-Gruppen erkennt. Durch die Fähigkeit, auch 5’pp-RNA zu erkennen, entzieht RIG-I dem Virus eine weitere Möglichkeit, sich molekular durch den ersten Schritt des Capping-Mechanismus (Dephosphorylierung von ppp) zu tarnen. Insgesamt spürt RIG-I damit wie eine molekulare Zange alle im biologischen System möglichen 5’RNA-Modifikationen (freie ppp und pp) auf, die im Zytosol der gesunden Wirtszelle nicht vorkommen und erschwert dadurch eine Immunevasion des Virus über die RNA-Struktur zusätzlich.
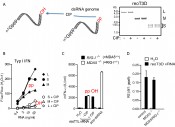
Abb.4 Die Erkennung von Reo-Virus-dsRNA basiert auf 5’Phosphorylierung: A: Genomische Reo-Virus-RNA wurde über Gelelektrophorese nach Größe getrennt und die verschiedenen Fraktionen aufgereinigt. Unbehandelte oder mit Phosphatase enzymatisch dephosphorylierte Reo-Virus-RNA wurde zur Stimulation der humanen Zell-Linie HEK293 (B), von murinen dendritischen Zellen oder von murinen embryonalen Fibroblasten mit MDA5 und/oder RIG-I-Defekt eingesetzt (C, D). Die Versuche zeigen, dass Dephosphorylierung von Reovirus-RNA, spezifisch die RIG-I-Aktivierung inhibiert (B-D).
Abb.5 Es gibt kein Entkommen: RIG-I erkennt auch Diphosphat-RNA: A: Humane Monozyten wurden mit verschiedenen Konzentrationen von pRNA, ppRNA oder pppRNA stimuliert und die induzierte Interferon-Mengen 24 Stunden danach gemessen. B: Wildtyp oder RIG-I-defiziente murine embryonale Fibroblasten wurden mit pRNA, ppRNA oder pppRNA stimuliert und die induzierte Interferon-Menge 24 Stunden danach gemessen. ppRNA zeigt eine gegenüber pppRNA reduzierte, aber immer noch starke Aktivierung von RIG-I, während pRNA inaktiv ist.
Programm gegen Autoimmunerkrankungen und Krebs Die Entschlüsselung der Viruserkennung durch das Immunsystem birgt ein großes Anwendungspotenzial: Basierend auf dem beschriebenen Erkennungsmotiv entwickeln wir künstlich hergestellte Imitate der Virus-RNA, sogenannte immunstimulatorische Oligonukleotide, die über RIG-I-Stimulation das Immunsystem in Richtung antivirale Immunantwort programmieren. Diese antivirale Programmierung des Immunsystems schützt als Immunstimulus in Tiermodellen nicht nur sehr effizient vor Virusinfektionen [8], sondern kann das Immunsystem bei Autoimmunerkrankungen wie multipler Sklerose auch in eine weniger schädliche Richtung lenken [9]. Durch Einbringen der Virusimitate in Tumore kann man eine virale Infektion vortäuschen, sodass vermeintlich infizierte Krebszellen durch das angeborene Immunsystem erkannt und eliminiert werden [10]. Die Aktivierung von RIG-I als neuer Ansatz für die Tumortherapie ist Teil der translationalen Forschung im DFG-geförderten Exzellenzcluster ImmunoSensation an der Universität Bonn.
Literatur |
L&M 10 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |