|
Forscher
>
Miriam Voigt
>
Röntgenmikroskopie zur Untersuchung von Zellkulturen, Organismen und Geweben
Röntgenmikroskopie zur Untersuchung von Zellkulturen, Organismen und GewebenDie gläserne ZelleSeit der Renaissance der Stammzellforschung und dem Aufkommen des Tissue Engineering nimmt das Interesse an dreidimensionalen Zellkulturen stetig zu. Die meisten Arbeiten dieser Art bemühen sich, die native Umgebung der Zellen im Organismus nachzubilden. An der Lübecker Fraunhofer EMB soll die 3D-Zellkultur in Hydrogelen jedoch ganz generisch als Plattformtechnologie für die effiziente Zellvermehrung entwickelt werden. Eines der Hauptprobleme aller 3D-Zellkulturen ist die Beobachtung der Zellen. Eine Lösung bietet die Röntgenmikroskopie. Diese Methode, die in der Halbleitertechnik Routine ist, fristet in den Lebenswissenschaften bislang ein wenig beachtetes Dasein. Zu Unrecht. Denn mittels Röntgenmikroskopie lassen sich zelluläre Auflösungen erzielen und die dreidimensionale Anordnung von Zellen in Geweben und Zellaggregaten aufklären. Durchblicken Das erste richtige Buch, das wir in der Schule lasen, hieß „Das gläserne Rätsel“. Es war die Geschichte Wilhelm Conrad Röntgens und seiner Entdeckung der „X-Strahlen“. Röntgen, der Experimentalphysiker war, hat in Zeiten, in der die gestrenge Trennung der Disziplinen als Tugend galt, bereits in seiner ersten Veröffentlichung (1895) auf die Verwendbarkeit seiner X-Strahlen für die medizinische Diagnostik verwiesen. Anfangs waren es hauptsächlich Knochen und Fremdkörper, die mit den X-Strahlen sichtbar gemacht werden konnten. Weiche Gewebe und Organe blieben zunächst unsichtbar.
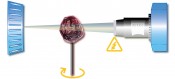
Abb.1Schematischer Aufbau eines Röntgenmikroskopes. Es gibt zwei Vergrößerungen, eine geometrische (Dia-Projektor-Prinzip) und eine optische (Objektiv). Am Szintillator wird das Röntgenbild in den sichtbaren Spektralbereich „übersetzt“. Dies liegt am Kontrastmechanismus, mit dem Röntgenbilder entstehen. Es handelt sich in der Regel um den einfachsten Kontrast überhaupt, den Amplitudenkontrast. Röntgenstrahlen werden in verschiedenen Materialien unterschiedlich absorbiert. Wo viele Röntgenstrahlen „stecken bleiben“ (z.B. im Knochen), bleibt es dunkel, während Bereiche, die relativ ungehindert durchdrungen werden, heller abgebildet werden. Mikroskopie und Hochauflösung Röntgenstrahlen, so wunderbar sie sich zum Durchleuchten vieler Materialien eignen, haben gerade deswegen auch ein gravierendes technisches Manko: Ein Röntgenmikroskop ist nicht ohne Weiteres konstruierbar. Das liegt daran, dass der Brechungsindex fast aller Materialien für Röntgenstrahlen praktisch eins ist; deswegen gibt es bis heute so gut wie keine Röntgenoptik. Röntgenapparate arbeiten deswegen in der Regel linsenlos, ohne optische Elemente. Die Auflösung dieser Anordnungen hängt von der Auflösung des Detektors und einem geometrischen Faktor ab. Im Grunde funktioniert ein Röntgengerät wie ein Diaprojektor. Man durchleuchtet das Objekt und wirft sein Amplitudenbild auf einen Schirm bzw. Detektor.
Abb.2Kopf einer Aallarve. Mit einer Auflösung von 1,6m pro Voxel lassen sich Zähne, Glaskörper der Augen, verschiedene Kammern des Gehirns, der Schlund, das Herz und die Muskulatur der Larve deutlich abbilden. Will man ohne Röntgenoptik zu höheren Auflösungen, muss man sich eines Tricks bedienen. Dieser Trick besteht in der Verwendung eines Szintillators. Der absorbiert die Röntgenquanten unter Aussendung von Lichtblitzen. Ein Szintillator „übersetzt“ ein Röntgen-Amplitudenbild in ein Amplitudenbild im sichtbaren Spektralbereich. Dieses Szintillationsbild kann mit einem herkömmlichen Objektiv vergrößert und auf eine Kamera projiziert werden. 2D zu 3D: eine Aallarve Aus Abbildung 1 geht hervor, dass im Röntgenmikroskop zunächst nur zweidimensionale (2D) Projektionen entstehen. Probendetails, die im Strahlengang hintereinanderliegen, lassen sich auf diese Weise nicht voneinander unterscheiden. Um die vollständige „vorn-hinten“-Information zu erhalten, wird die Probe im Strahlengang gedreht. Bei dieser Tomographie werden einige hundert bis tausend Projektionen aufgenommen. Danach können die Daten durch Rückprojektion in das ursprüngliche Probenvolumen zu einem volumetrischen (XYZ)-Datensatz rekonstruiert werden. Die Leistungsfähigkeit dieser Methode soll an der Larve eines Aals demonstriert werden (ca. 1,0 x 0,3 cm). Sie wurde in 100% Ethanol fixiert und mit Phosphorwolframsäure angefärbt. Diese Färbung ist nicht nur einfach und ungiftig, sondern liefert auch exzellenten Kontrast und eine scharfe Differenzierung von unterschiedlichem Gewebe [Metscher et al., 2009]. Nach der Färbung muss die Probe so fixiert werden, dass sie sich über mehrere Stunden für die Aufnahme der Projektionen nicht bewegt. Dazu können die Proben entweder in Hydrogelen eingebettet oder in konischen Gefäßen festgeklemmt werden. Die Aallarve wurde mit einem 4x-Objektiv aufgenommen. Von besonderem Interesse war der Kopf, um die Reißzähne in diesem Larvenstadium deutlich abzubilden. Je höher die Auflösung, desto länger dauern die Aufnahmen; die hier erzielte Auflösung von 1,6m erfordert ca. 8 h Aufnahmezeit. Maximal kann das Xradia 510 Versa ca. 800 nm auflösen; solche hochauflösenden Aufnahmen dauern bis zu 72 h.
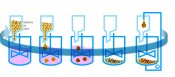
Abb.3Kreislaufprozess für einen kapselbasierten Bioreaktor. Dargestellt sind die einzelnen Phasen von der Verkapselung und Kultivierung bis zur Wiederbereitstellung der Zellen. Vorteile dieses voll automatisierbaren Kultivierungsprozesses sind sowohl die einfache Inokulation und Zellernte als auch der mechanische Schutz der Zellen in der Kapsel-Mikro-Umgebung. Von Zellen in Gelen Für die Abbildung kleiner Organismen wird die Röntgenmikroskopie zwar nicht so häufig genutzt wie Licht-, Fluoreszenz- und Elektronenmikroskopie, aber vereinzelt wurden solche Arbeiten bereits publiziert. Im Folgenden aber wollen wir Neuland mit dem Röntgenmikroskop betreten. Uns interessieren Zellen, die in Hydrogelen wachsen. Von dieser „kapselbasierten Zellkultur“ erhoffen wir uns entscheidende Verbesserungen bei der Vermehrung adhärent wachsender Zellen. Die großtechnische und effiziente Herstellung adhärent wachsender Zellen ist nach wie vor eine ungeklärte technische Fragestellung. An Anwendungen hingegen fehlt es nicht: Sowohl in der personalisierten Medizin als auch in der therapeutischen Antikörperherstellung gibt es großen Bedarf. Derzeit erfolgt die Kultivierung adhärent wachsender Zellen auf Carriern oder in Hohlfasersystemen. Die Vermehrung kann nur in bestimmten Dichtebereichen stattfinden (500–50.000 Zellen/cm2) und ist deshalb auf den Faktor 102–103 beschränkt. Für großtechnische Anwendungen wären Vermehrungsfaktoren >106 erstrebenswert. An der Fraunhofer EMB in Lübeck wurde ein zyklisch arbeitendes Reaktorprinzip entwickelt und bereits zum Patent angemeldet. Abbildung 3 stellt das Prinzip schematisch dar. Der Prozess beginnt mit dem Bereitstellen der Zellen als Suspension in einem Gelbildner. Die Zellsuspension wird tropfenweise in das Kulturmedium gegeben, das einen Vernetzer enthält und zur Kapselbildung führt. Die entstandenen Zellkapseln werden kultiviert (Expansion ca. um eine Größenordnung). Das Freisetzen der Zellen erfolgt durch Zugabe eines gelauflösenden Agens. Zu guter Letzt werden die Zellen wieder im Gelbildner resuspendiert und für die erste Phase bereitgestellt. Im Gegensatz zu herkömmlichen Carrier-Verfahren kann der Reaktor auch bei sehr kleinen Startzellzahlen bereits in seiner Endgröße betrieben werden. Weil die Zellen mehrheitlich im Innern der Kapseln wachsen, wird das Reaktorvolumen bei hoher Volumenbelegung wesentlich effizienter genutzt. Der Schutz vor Scher- und Prallkräften ermöglicht höhere Stoffströme und dadurch höhere Besiedlungsdichten. Die herkömmlichen Schritte der Inokulation/Zellernte entfallen und werden durch die Prozesse des Verkapselns bzw. Kapselauflösens ersetzt. Schließlich wachsen die Zellen in einer dreidimensionalen Umgebung, was sowohl für die verbesserte Funktionalität als auch für den Erhalt der Identität der Zellen in Kultur wichtig ist. Bei allen genannten Vorteilen der kapselbasierten Zellkultur gibt es auch einen Nachteil: Die Zellen lassen sich schlecht im Inneren der Kapseln mikroskopieren. Die herkömmliche Analyse durch Dünnschnitte mit anschließender Färbung ist aufwendig und die fragilen Schnitte gelingen nicht immer. Hier spielt die Röntgenmikroskopie ihre entscheidenden Stärken aus. Obwohl es wegen des zunächst schlechten Kontrastes ungewöhnlich ist, diese Technik an Hydrogelen anzuwenden, können mit geeigneten Kontrastmitteln sehr einfach Abbildungen des dreidimensionalen Wachstums der Zellen im Innern der Kapseln erzeugt werden. Die röntgenmikroskopische Analyse des Zellwachstums erfolgte beispielhaft an einem modifizierten dextranbasierten Hydrogel. In Abbildung 4 sind erste Aufnahmen dieses Gels mit Zellen zu sehen.
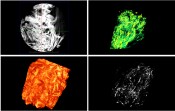
Abb.4 Röntgenmikroskopische Aufnahmen von Zellen in einer dextranbasierten Kapsel. In 4a) ist die 2D-Projektion der xy-Ebene innerhalb des Hydrogels zu sehen. Zur verbesserten Darstellung wurden die rekonstruierten Aufnahmen digital eingefärbt (4b, c). Nach Erhöhung der virtuellen Transparenz aus Bild c) sind in d) zellähnliche Strukturen zu erkennen. Die Auflösung der Bilder beträgt 850 nm und wurde mit einem 4x-Objektiv erzielt. Die Röntgenmikroskopie ermöglicht also, bei Verwendung passender Färbemethoden in Organismen und Geweben durchsichtig zu belassen, was wir nicht sehen wollen und selektiv zu beleuchten, was uns interessiert. Von Goethe ist überliefert, dass er meinte, die Klarheit eines Glases Wasser könne am besten bewiesen werden, indem man es hinhält. Durch das Röntgenmikroskop werden die Organismen zum Wasserglas. Hingucken und verstehen müssen wir selbst. |
L&M 7 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |