|
L&M-1-2015
>
Vitamin D-Mangel lässt Blutgefäße verkalken
Vitamin D-Mangel lässt Blutgefäße verkalkenKalk in den AdernBisher sollen nur toxische Dosen an Vitamin D für eine Verkalkung der Gefäße verantwortlich sein, doch zeigen neue Erkenntnisse in verschiedenen Tiermodellen, dass auch Vitamin D-Mangel die Gefäßkalzifizierung fördert. Entscheidend für den Krankheitsverlauf, bei dem diese vaskulären Veränderungen durch Vitamin D-Mangel eine Rolle spielen, könnten Transdifferenzierungen von vaskulären Zellen zu osteoblastenähnlichen Zellen sein. Vitamin D kann auf eine lange Geschichte zurückblicken. Obgleich der Vitamin D-Mangel bereits Mitte des 17. Jahrhunderts wissenschaftlich beschrieben wurde, gelang es erst im 20. Jahrhundert, die chemische Struktur der D-Vitamine aufzuklären. Adolf Windaus von der Universität Göttingen, der wesentlich zur Erforschung der Sterine und ihren Zusammenhang mit Vitaminen beitrug, erhielt dafür im Jahr 1928 den Nobelpreis für Chemie. Vitamin D als Vitamin zu bezeichnen, ist streng genommen nichtzutreffend, da es weder ein Amin ist noch zwingend mit der Nahrung aufgenommen werden muss. In der Natur kommt Vitamin D als Cholecalciferol (Vitamin D3) oder Ergocalciferol (Vitamin D2) vor. Es wird seit mehr als 500 Mio. Jahren in Lebewesen produziert, vermutlich, um Nukleinsäuren und Proteine vor der schädlichen UV-Strahlung zu schützen.
Abb.1 links: Cholecalciferol (Vitamin D3); rechts: Ergocalciferol (Vitamin D2)
Von der Cholesterolsynthese zum Schlüsselregulator Mit Ausnahme einiger fettreicher Fischarten enthalten Lebensmittel nur sehr geringe Mengen an Vitamin D. Der Haupteintrag erfolgt durch endogene Synthese nach Exposition der Haut mit ultravioletter Strahlung im Wellenlängenbereich zwischen 290 und 310nm (Abb.2). Als Ausgangssubstrat dient kutanes 7-Dehydrocholesterol aus dem Kandusch Russell Pathway der Cholesterolsynthese. Durch Photoisomerisierung entsteht das chemisch instabile Prävitamin D3, das in einer zeit- und temperaturabhängigen Reaktion zu Vitamin D3 umgewandelt wird. Melanin konkurriert mit 7-Dehydrocholesterol in der Haut um UV-B-Photonen und schützt vor den Auswirkungen intensiver UV-Strahlung. Bis auf wenige Ausnahmen ist zu beobachten, dass die Haut von äquatorfern lebenden Menschen deutlich weniger Pigmente aufweist als die von Menschen in Regionen hoher UV-Intensität. Die Entwicklung hin zu einem helleren Hauttyp wird als selektiver Evolutionsschritt betrachtet, die Vitamin D-Versorgung äquatorfern lebender Menschen zu sichern [1].
Abb.2 Die endogene UV-abhängige Synthese von Vitamin D im Stratum spinosum und Stratum basale der Epidermis; bei UV-Bestrahlung entstehen auch zahlreiche inaktive Vitamin D-Metaboliten.
Alimentär aufgenommenes Vitamin D und endogen gebildetes Vitamin D werden im Blut an ein Vitamin D-Bindungsprotein gekoppelt und in der Leber mithilfe von 25-Hydroxylasen zu 25-Hydroxyvitamin D (25(OH)D) umgewandelt. Da diese Reaktion in erster Linie von der Substratmenge abhängt, spiegelt 25(OH)D im Plasma den aktuellen Vitamin D-Status relativ gut wider. 25(OH)D wird deshalb auch als Biomarker zur Beurteilung des Vitamin D-Versorgungsgrades verwendet, obgleich die Höhe der optimalen 25(OH)D-Spiegel zur Prävention von Krankheiten derzeit noch kontrovers diskutiert wird. In den Nieren wird 25(OH)D mithilfe der 1a-Hydroxylase in das stoffwechselaktive Vitamin D-Hormon (Calcitriol) überführt. Calcitriol ist ein Schlüsselregulator der intestinalen Calcium- und Phosphatabsorption. Diese Funktion erfüllt Calcitriol nur in Wechselwirkung mit dem 1969 entdeckten Vitamin D-Rezeptor, einem ligandenaktivierbaren Transkriptionsfaktor aus der Familie der Steroidrezeptoren (Abb.3).
Abb.3 Wirkung des Vitamin D-Rezeptors (VDR) als Transkriptionsfaktor; CoReg: Co-Regulatoren, RXR: Retinoid X-Rezeptor
Die Bindung von Calcitriol an den Vitamin D-Rezeptor löst in diesem eine Konformationsänderung aus. Nach Translokation des Komplexes in den Zellkern und Heterodimerisierung mit dem Retinoid X-Rezeptor erfolgen die Bindung an Vitamin D-responsive Elemente der DNA und unter Beteiligung von Coaktivatoren und -repressoren die Transkription von Genen (Abb.4). Mit der Identifizierung von mehr als 2.700 Vitamin D-Rezeptorbindungsstellen im humanen Genom [2] sowie der Entdeckung, dass Vitamin D auch nichtkodierende RNA und epigenetische Prozesse beeinflusst [3], wurde deutlich, wie umfassend die Wirkungen von Vitamin D im Organismus vermutlich sind.
Abb.4 Struktur des Vitamin D-Rezeptors (Bildquelle: http:/
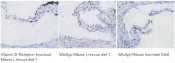
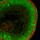
Vaskuläre Zellen unter dem Einfluss von Vitamin D Vitamin D-Rezeptoren wurden auch in Kardiomyozyten, Endothelzellen sowie glatten Muskelzellen nachgewiesen. Untersuchungen an Vitamin D-Rezeptor-defizienten Mäusen haben gezeigt, dass diese im Bereich der Herzklappen mehr Kalzifizierungen aufweisen als vergleichbare Wildtypmäuse [4]. Die Zunahme der Kalzifizierung war auch zu beobachten, wenn Wildtyp-Mäuse und LDL-Rezeptor-defiziente Mäuse über einen längeren Zeitraum Vitamin D-arm ernährt wurden (Abb.5) [5]. Diese vaskulären Kalzifizierungen traten unabhängig von arteriosklerotischen bzw. inflammatorischen Prozessen auf und verstärkten sich mit Dauer des Vitamin D-Mangels. Die Plasmakonzentrationen an Calcium und Phosphat blieben hingegen unverändert und lieferten keine Erklärung für die beobachteten Effekte. Studien an Vitamin D-Rezeptor-defizienten Mäusen sowie Vitamin D-arm ernährten Mäusen machten deutlich, dass die besonders kalzifizierungsgefährdeten Gefäßbereiche bei Vitamin D-Mangel eine besonders hohe Expression der Osteoblastendifferenzierungsfaktoren Runt-related transcription factor 2 (RUNX2), Bone morphogenetic protein 2 (BMP2) oder Msh homeobox 2 (MSX2) aufwiesen (Abb. 6) [4,5].
Abb.5 A) Histologische Auswertung von Gefrierschnitten mit Darstellung der Kalzifizierung (schwarz, Von-Kossa-Siberfärbung) im Bereich der Aortenklappen von Vitamin D-Rezeptor-knock-out-Mäusen (gefüttert mit einer calcium- und phosphatreichen rescue diet) im Vergleich mit Wildtypmäusen, die entweder eine rescue diet oder eine Diät mit normaler Calcium- und Phosphatversorgung erhielten. B) Auswertung der Kalzifizierungsflächen und C) Zahl der Kalzifizierungsspots in den Aortenklappen von Vitamin D-Rezeptor-knock-out-Mäusen (VDR-/-) und Wildtyp-Mäusen (WT), die eine rescue diet (RD) oder Diät mit normaler Calcium- und Phosphatversorgung (ND) erhielten (Daten publiziert in [4]).
Abb.6 Expression des Runt-related transcription factors 2 (RUNX2) in der Aortenklappe von Vitamin D-Rezeptor-knock-out Mäusen (gefüttert mit einer calcium- und phosphatreichen rescue diet) im Vergleich mit Wildtypmäusen, die entweder eine rescue diet oder eine Diät mit normaler Calcium- und Phosphatversorgung erhielten (Daten publiziert in [4]).
Die induzierten Veränderungen durch Vitamin D-Mangel waren im Gefäßsystem mit einer vermehrten Bildung Alkalischer Phosphatase und einer verminderten Expression von a-Aktin als Marker für glatte Muskelzellen verbunden [5]. Die Ergebnisse lassen vermuten, dass sich bei Vitamin D-Defizit vaskuläre Zellen zu osteoblastenähnlichen Zellen umwandeln und diese – ähnlich den Knochenzellen – Calcium und Phosphat aus dem Plasma aufnehmen und anreichern. Die Ergebnisse könnten erklären, warum Patienten mit chronischen Nierenerkrankungen und einer gestörten Calcitriolsynthese häufig eine ausgeprägte Kalzifizierung im Bereich der arteriellen Gefäße aufweisen und weshalb niedrige 25(OH)D-Spiegel mit dem Auftreten von Verkalkungen im Bereich der Aorta assoziiert sind. Schlussbemerkung Entgegen der weit verbreiteten Meinung, dass nur toxische Dosen an Vitamin D eine vaskuläre Kalzifizierung induzieren, zeigen neue Erkenntnisse in verschiedenen Tiermodellen, dass auch Vitamin D-Mangel die Gefäßkalzifizierung fördert. Der zu Grunde liegende Pathomechanismus für diese vaskulären Veränderungen bei Vitamin D-Mangel basiert vermutlich auf einer Transdifferenzierung von vaskulären Zellen zu osteoblastenähnlichen Zellen.
Literatur Bild: © istockphoto.com| Storman |
L&M 1 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |