|
L&M-5-2013
>
Maßgeschneiderte In-vivo-Assays als tierschutzkonforme Alternative in der Wirkstoffentwicklung
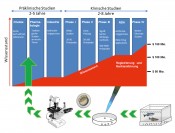
Maßgeschneiderte In-vivo-Assays als tierschutzkonforme Alternative in der WirkstoffentwicklungDie Wahl der BestenDie chemische Industrie gilt traditionell als Großverschmutzer und Katastrophenverursacher. Um diesem schlechten Ruf entgegenzuwirken und immer strenger werdende gesetzliche Vorlagen zu erfüllen, werden seit nun mehr als zwei Jahrzehnten enorme Bemühungen in den Ausbau der „Grünen Chemie“ investiert. Dabei gelten bis heute folgende Prinzipien als Fundament einer nachhaltigen chemischen Produktion: Abfallvermeidung statt -entsorgung, Ressourcen wie Erdöl und Wasser schonen, erneuerbare Rohstoffe bevorzugen, gefährliche Chemikalien ersetzen und Großanlagen sicher betreiben. Auch wenn dieses Öko-Image der Industrie vor allem in den Köpfen der Bevölkerung nicht immer aufgeht, bleiben dennoch einige Fakten positiv hervorzuheben: Die Zahl an Chemieunglücken hat sich stark verringert, der Regen in Deutschland ist aufgrund besserer Schwefeldioxidfilter weniger sauer und das Wasser aus Flüssen wie Donau, Rhein und Oder fließt sauberer. Verantwortung gegenüber Mensch und Tier Was in der chemischen Produktion von Massenchemikalien die Verantwortung für Mensch und Umwelt bedeutet, ist im pharmazeutischen Industriezweig der Chemie gleichbedeutend mit der Verantwortung gegenüber Mensch und Tier. Die In-vitro-Technik gilt als Domäne der Biologie, die es sich zur Aufgabe gemacht hat, der Wirkstoffaktivität und -toxizität an Zellen und Geweben tierischer und pflanzlicher Herkunft nachzugehen. Die gewonnenen Erkenntnisse werden dann bestmöglich auf den Menschen übertragen. Diese Methodik ist sowohl in den großen Pharmaunternehmen als auch in der Lehre an Universitäten fest verankert und gilt als Meilenstein in der Reduzierung von Säugetierversuchen. Die Entwicklung neuer Wirkstoffe, deren Synthese und Charakterisierung bleibt allerdings zentrale Aufgabe der Chemie, im Speziellen der Medizinalchemie. Das übliche Vorgehen eines Medizinalchemikers liegt dabei in der Erkennung biochemischer Mechanismen, die für ein bestimmtes Krankheitsbild charakteristisch wirken bzw. eine Wirkung induzieren. Wurde eine solche Zielstruktur identifiziert, was beispielsweise ein spezielles Enzym sein kann, so wird dieses durch charakteristische Wechselwirkungen mit Wirkstoffkandidaten beeinflusst, um den erwünschten Effekt auszulösen. Die „besten“ Kandidaten durchlaufen dann im Rahmen präklinischer Studien geeignete Tierversuche, um anschließend die klinischen Testphasen zu erreichen. Besteht ein Wirkstoff sämtliche Phasen und Prüfungen, so steht auf dem Weg zum Medikament nur noch die Zulassung. Was sich hier wie eine Kausalkette anhört, ist tatsächlich ein mühseliger und langer Prozess, der immer enorme Kosten bis zur Registrierung und Markteinführung eines Wirkstoffes verursacht. Die Rolle der Chemie in der Wirkstoffentwicklung Bei der schematischen Betrachtung des zeitlichen Verlaufs der Wirkstoffevaluierung (Abb. 1) ist der Chemiker auf der ersten Säule anzusiedeln und stellt nach verrichteter Arbeit eine Vielzahl an potenziell geeigneten Wirkstoffkandidaten bereit.
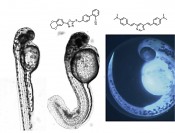
Abb. 1 Verlauf der Wirkstoffentwicklung von Laborsynthese bis Markteinführung (oben) und die schematische Einordnung des neuen Forschungsschwerpunks von Prof. Boris Schmidt in das Gesamtkonzept (unten). Auf diesem noch relativ niedrigen Wissensstand werden diese Kandidaten traditionell aus den Händen der Chemie an die Biologie und Medizin weitergereicht. Nun entscheiden pharmakokinetische und toxikologische Studien, welche Verbindungen sich besonders eignen. Sofern möglich, erfolgt diese Selektion durch zelluläre In-vitro-Assays. Viele Fragestellungen können jedoch trotz aller Fortschritte der In-vitro-Technik erst im Gesamtorganismus beantwortet werden. Aufgrund der Nähe zum Menschen kommen dazu typischerweise Säugetiere zum Einsatz, im Speziellen Mäuse, Ratten und Kaninchen zum Einsatz. Die vollständige Verdrängung von Versuchen an Säugetieren im Zuge der Wirkstoffentwicklung wird in naher Zukunft kaum möglich sein. Motivation eines jeden Gliedes der Entwicklungsmaschinerie sollte dennoch die Reduzierung der für die Tiere oftmals qualvollen Praktiken durch den Ersatz durch tierschutzkonforme In-vivo-Systeme sein. Frühe Testung der Wirkstoffkandidaten Eine Literaturrecherche zu derartigen Assays führt schnell zum Zebrafischembryonenmodell. Aufgrund der neuen europäischen REACH-Bestimmungen, welche die Testung unzähliger Altchemikalien vorschreibt, erfährt der so genannte Fischembryonentoxizitätstest (FET) eine Art Renaissance. Im FET werden toxikologische Daten anhand spezifischer Phänotypen am Zebrafischembryo erfasst, was sich bereits in automatisierten Screeningverfahren bewährt hat und 2007 vom Deutschen Institut für Normung als Methodik für Risikobewertung von Chemikalien in der Ökotoxikologie aufgenommen wurde (DIN 38 415-6, ISO 15088) [1]. In einem medizinalchemisch ausgerichteten Arbeitskreis werden stetig neue potenzielle Wirkstoffe produziert, die verschiedenste Wege in die Testung finden. Dies führt mittlerweile zu großen Verzögerungen und hohem Kostenaufwand und wird deshalb nicht selten zum Nadelöhr der Wirkstoffentwicklung. Die Möglichkeit, erste biologische Daten zur Aussortierung ungeeigneter Derivate im eigenen Labor erheben zu können, führt zu effizienteren Arbeiten und macht eine Vielzahl an weiterführenden externen Testungen hinfällig. Das Vorgehen, das nun seit bereits drei Jahren im AK Prof. Boris Schmidt verfolgt wird, knüpft am FET an, konzentriert sich allerdings auf die Entwicklung krankheitsspezifischer In-vivo-Assays an Zebrafischembryonen. Dies macht es möglich, einen gewünschten bzw. unerwünschten Effekt eines potenziellen Wirkstoffs direkt nach dessen Synthese im eigenen Labor zu verfolgen. Im Falle neurodegenerativer Erkrankungen wie Morbus Alzheimer kann dies neben der rein toxikologischen Evaluation der Wirkstoffe zusätzlich der Wirknachweis durch spezifische Phänotypen früher Entwicklungsstadien des Fisches sein. So führt beispielsweise die Inhibition der im Entstehungsprozess der Alzheimer-Demenz beteiligten Kinase GSK-3 in der Zebrafischlarve zu Entwicklungsstörungen, die unter dem Mikroskop anhand charakteristischer Rückgratverkrümmung bereits in einem Alter von zwei Tagen nachzuweisen sind (Abb. 2) [2].
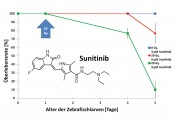
Abb. 2 Normal entwickelte, dechorionierte Zebrafischlarve (2 Tage alt) (links). Fehlgebildete, dechorionierte Zebrafischlarve (2 Tage alt). Die Inhibition von GSK-3 durch BSc4263 (2,5 µM) führt zu charakteristischen Phänotypen (mitte) [2]. Eingefärbte Zebrafischlarve im Chorion (2 Tage alt) (rechts). Verteilung und Anreicherung des Fluorophors BSc4090 (3 µM) lässt sich am Fluoreszenzmikroskop verfolgen [3]. Auch Fluoreszenzfarbstoffe, die zur selektiven Färbung der im Verlauf der Krankheit entstehenden Proteinablagerungen Tau und A? entwickelt werden, benötigen einen maßgeschneiderten Assay. Denn die Hürde, die ein solcher Farbstoff überwinden muss, um den Hort der Ablagerungen, das Gehirn, zu erreichen, ist die Blut-Hirn-Schranke (BBB) [3]. Obgleich bei einem Zebrafischembryo wohl kaum eine Alzheimer-Demenz zu erwarten ist, lässt sich dennoch der Transport des Fluorophors durch die Blutgefäße bis zum Gehirn beeindruckend am Fluoreszenzmikroskop verfolgen. Erst wenn ein solches Experiment positiv verläuft, erfolgt die weitere Testung an Säugetieren bis hin zur Entwicklung eines BBB-permeablen Wirkstoffs. Radiosensibilisatoren für die Strahlentherapie Ein weiterer Schwerpunkt des Arbeitskreises besteht in der Entwicklung und Evaluation von Radiosensibilisatoren. Dabei handelt es sich um Substanzen, die Tumore empfindlicher für ionisierende Strahlung machen mit der Absicht, in der Radiotherapie niedrigere Strahlendosen zu ermöglichen. Umliegendes, gesundes Gewebe nimmt dann weniger Schaden. Die übliche Vorgehensweise der Forschungsinstitute und pharmazeutischen Industrie ist die Evaluierung der Wirkstoffdosis in Kombination mit ionisierender Strahlung am Mausmodell. Im Rahmen des DFG-geförderten Graduiertenkollegs 1657 konnte jüngst ein In-vivo-Assay aufgebaut werden, das den synergistischen Effekt aus Röntgenstrahlung und Wirkstoff leicht zugänglich macht. Es wird kaum überraschen, dass unsere Wahl auch hier auf die Zebrafischlarve fiel. Nachdem die Eier ein Tag alt sind, erfolgt die Vergabe des Wirkstoffs in verschiedenen Konzentrationen und die Bestrahlung mit der hohen Dosis von 20 Gy. An den darauffolgenden Tagen wird das Überleben bestrahlter und nichtbestrahlter Embryonen verfolgt und am fünften Tag abgebrochen. Die erhaltenen Überlebenskurven erlauben neben der Identifikation radiosensitivierender Wirkung auch eine Abschätzung der Toxizität (Abb. 3).
Abb. 3 Synergistischer Effekt aus ionisierender Strahlung und Wirkstoff, exemplarisch am Rezeptor-Tyrosinkinase-Inhibitor Sunitinib [4]. Der Wirkstoff ist in 3-µM-Konzentration nicht toxisch (blaue Linie). Röntgenbestrahlung führt zum Sterben der Larven ab dem vierten Tag (rote Linie). Im Vergleich dazu hat die Kombination aus Sunitinib und ionisierender Strahlung eine signifikante Erhöhung der Toxizität zur Folge (grüne Linie). Wirkstoffzugabe und Bestrahlung erfolgt am ersten Tag. Es sind Mittelwerte mit Standardabweichungen aus Triplikat-Experimenten mit jeweils 10 Zebrafischeiern abgebildet. Neue Proteasominhibitoren im Fokus Neben der Fähigkeit, Zellen empfänglicher für ionisierende Strahlung zu machen, stehen Inhibitoren des 26S-Proteasoms als Initiatoren des programmierten Zelltods seit über 20 Jahren im Fokus der Krebsforschung. Diese Substanzklasse ermöglicht durch Eingriff in den zellulären Stoffwechsel das Sterben der schnell wachsenden Krebszellen mit weitgehender Verschonung gesunder Zellen. Zwei Proteasominhibitoren (Bortezomib und Carfilzomib) sind bereits durch die FDA als Chemotherapeutika zur Behandlung des multiplen Myeloms und des Mantellzelllymphoms zugelassen [5]. Beide Wirkstoffe lösen aufgrund mangelnder Selektivität als Nebenwirkung die schwere Nervenkrankheit „periphere Neuropathie“ aus [6]. Neu entwickelte Proteasominhibitoren aus unserem Arbeitskreis sollen ohne diese Nebenwirkung auskommen. Üblicherweise wird die Penetration des Gehirns nach Injektion der Wirkstoffe in Mäusen und Ratten ermittelt. Unser Vorgehen nutzt den bereits im Embryonalstadium ausgebildeten Fluchtreflex des Zebrafischembryos als Maßstab für Neurotoxizität. Nach einem äußeren Reiz wird die Reaktion einer dechorionierten Larve mit einer Hochgeschwindigkeitsdigitalkamera (500 Bilder pro Sekunde) aufgezeichnet (Abb. 4).
Abb. 4 Fluchtreflex einer gesunden, zwei Tage alten Larve, ausgelöst durch äußeren Nadelreiz (Zeitpunkt t = 0 ms). Die Bilderfolge zeigt einen Schwanzausschlag in einem Zeitintervall von 206 ms. Spezielle Software misst den Winkel der Körperbiegung bzw. den Winkel der Auslenkung des Schwanzes. Diese Messdaten ermöglichen die Quantifizierung sensorischer Innervierung der Larve und erlauben den direkten Vergleich mit den zugelassenen Medikamenten als Referenzsubstanzen. Mit dem neuen Forschungsschwerpunkt Assay-Entwicklung im Arbeitskreis Boris Schmidt werden tierschutzkonforme Alternativen zu Säugetierversuchen entwickelt und ausgebaut, zusätzlichwertvolle biologische Daten erhoben, die zur frühzeitigen Trennung der Spreu vom Weizen der Wirkstoffentwicklung führen.
Literatur
Foto: dpa Picture-Alliance GmbH |
L&M 5 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |