|
Neue Möglichkeiten für verbesserte Wundheilung
Neue Möglichkeiten für verbesserte Wundheilung
Wissenschaftler des Universitätsklinikums Greifswald untersuchen zusammen mit dem Leibniz-Institut für Plasmaforschung und Technologie e.V. (INP Greifswald) seit Juli 2008, wie Plasma in der Wundheilung und Hygiene wirkungsvoll eingesetzt werden kann. Die Leitthemen PlasmaCure und PlasmaDent laufen im Rahmen des vom BMBF geförderten Projekts Campus PlasmaMed.
Plasma, der 4. Aggregatzustand

Physikalisches Plasma wird auch als der 4. Aggregatzustand der Materie bezeichnet, den man sich gut am einfachen Beispiel des Wassers vorstellen kann. Als Eis liegt es in fester Form vor. Führt man Energie zu, schmilzt das Eis zu Wasser und liegt in flüssiger Form vor. Führt man weiter Energie zu, verdampft das Wasser und liegt schließlich gasförmig vor. Wird einem Gas noch mehr Energie zugeführt, entsteht ein Plasma– ein Zustand, in dem sich aus den Gasatomen äußere Elektronen lösen. Es entstehen reaktive Radikale sowie UV- Strahlung. Die mittlere Temperatur kann dabei Raumtemperatur haben („Niedertemperatur-Plasmen“) und ist für den Einsatz im medizinischen Bereich geeignet.
Plasma wirkt antimikrobiell
Bereits früh konnte die antimikrobielle Wirkung von Plasma auf planktonische Erreger experimentell nachgewiesen werden [1]. Hierzu wurden Testkeime auf Agarplatten ausgestrichen und mit Plasma behandelt [2]. Es konnten nach kurzer Behandlungszeit Hemmhöfe nachgewiesen werden. Grund für Infektionserkrankungen sind meist in Biofilmen lebende Bakterien (z.B. chronisch infizierte Wunden, Parodontitis). Dabei hüllen sich die Erreger in eine extrazelluläre polymere Matrix (bestehend aus Polysacchariden, Proteinen, Lipiden und Nukleinsäuren) ein, in der sie vor Umwelteinflüssen, antimikrobiellen Substanzen und physikalischen Einflüssen geschützt sind. Daher haben auch die handelsüblichen Antiseptika
Probleme mit der Abtötung von Biofilmen. Plasma könnte diese Probleme lösen. Es konnte gezeigt werden, dass mit unterschiedlichen Plasmaquellen eine deutliche Reduktion der Mikroorganismen in Biofilmen, deren Stoffwechselaktivität und eine Hemmung des Wachstums in Abhängigkeit der Anwendungszeit möglich ist [3] [4, 5]. Die Abbildung 1 zeigt die zur Verfügung stehenden Plasmaquellen. Wir untersuchten die antimikrobielle
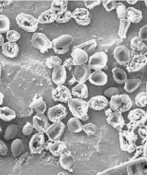 Wirksamkeit von Plasma bei Monospezies- und Multispeziesbiofilmen [6] [3] [5]. Die höchsten Reduktionsraten betrugen 5 log10 Stufen. Chlorhexidin als Goldstandard-Antiseptikum schaffte in dieser Zeit nur eine Reduktion von 1,5 log10 Stufen. Im Rasterelektronenmikroskop wurde die Zerstörung der Zellmembran sichtbar (Abb. 2). Ebenso konnten im konfokalen Laserrastermikroskop (CLSM) mittels Live-Dead-Färbung Membranschäden detektiert werden (Abb. 3).
Wirksamkeit von Plasma bei Monospezies- und Multispeziesbiofilmen [6] [3] [5]. Die höchsten Reduktionsraten betrugen 5 log10 Stufen. Chlorhexidin als Goldstandard-Antiseptikum schaffte in dieser Zeit nur eine Reduktion von 1,5 log10 Stufen. Im Rasterelektronenmikroskop wurde die Zerstörung der Zellmembran sichtbar (Abb. 2). Ebenso konnten im konfokalen Laserrastermikroskop (CLSM) mittels Live-Dead-Färbung Membranschäden detektiert werden (Abb. 3).
Plasma kann die Wundheilung und Einheilung von Implantaten fördern
Es besteht die begründete Chance, durch Oberflächenveränderungen mittels Plasma die Implantateinheilung zu fördern. Nach nur kurzer Plasmabehandlung
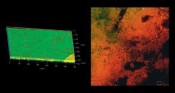 konnte der Kontaktwinkel auf verschiedenen Vitanimplantatoberflächen von 90 ° auf superhydrophil (< 5 °) gesenkt werden. Der Grad der Hydrophilität beeinflusst die Zellanlagerung. Die Einheilung von Implantaten könnte dadurch verbessert werden. Darüber hinaus ist eine Förderung der Wundheilung durch Plasma aufgrund folgender Teilwirkungen vorstellbar [7]:
konnte der Kontaktwinkel auf verschiedenen Vitanimplantatoberflächen von 90 ° auf superhydrophil (< 5 °) gesenkt werden. Der Grad der Hydrophilität beeinflusst die Zellanlagerung. Die Einheilung von Implantaten könnte dadurch verbessert werden. Darüber hinaus ist eine Förderung der Wundheilung durch Plasma aufgrund folgender Teilwirkungen vorstellbar [7]:
- Debridierende Wirkung auf der Wundoberfläche [8],
- antimikrobielle Wirksamkeit gegen anhaftende Bakterien und Biofilme [3, 5],
- antimikrobielle Wirkung gegenüber multiresistenten Erregern [9],
- Gewebeerwärmung [10], Durchblutungsförderung [11] und Förderung der Angiogenese [12],
- Förderung von Zellproliferation und -differenzierung in der Wundtiefe [13],
- Förderung der Penetration von Wirkstoffen in die Wunde [14] und
- Stimulierung für die Abwehr verantwortlicher Zellleistungen durch lokale Bildung endogener Radikale.
Zudem sind schwer erreichbare Entzündungsherde am Körper und vielleicht im Körper (z.B. Gelenke, Zahnimplantate) durch die Verteilung des Plasmas im Gasstrom erreichbar. Somit könnte Plasma in Zukunft eine interessante Therapieoption für eine verbesserte Heilung von Wunden sowie infizierten Implantaten sein.
Literatur
[1.] Daeschlein, G., et al., Antibacterial Activity of an Atmospheric Pressure Plasma Jet Against Relevant Wound Pathogens in vitro on a Simulated Wound Environment. Plasma Processes and Polymers, 2010. 7(3 – 4): p. 224 – 230.
[2.] Matthes, R., et al., Screening test for quality control of surface barrier discharged plasma sources with the microorganismagar test (MAT) Screeningmethode zur Qualitätsprüfung flächiger Plasmaquellen mit dem Mikro - organismen-Agar-Test (MAT). GMS Krankenhaushygiene Interdisziplinär, 2010. 5(2): p. DOC02.
[3.] Koban, I., et al., Antiseptische Wirksamkeit ausgewählter Wirkstoffe und von tissue tolerable plasma (TTP) auf C. albicans-Biofilme – hat der Reifegrad des Biofilms einen Einfluss? Antiseptic efficacy of selected agents and tissue tolerable plasma (TTP) on C. albicans biofilms – has the biofilm maturity influence on it? . GMS Krankenhaushyg Interdiszip, 2009. 4(2): p. 1 – 8.
[4.] Matthes, R.B., Claudia ; Hübner, Nils-Olaf ; Müller, Gerald ; Kohl, Katharina ; Mentz, Jaqueline ; Koban, Ina ; Kindel, Eckhard ; Kocher, Thomas ; Weltmann, Klaus-Dieter ; Lade mann, Jürgen ; Kramer, Axel, Beeinflussung derPenetration von Pseudomonas aeruginosa in eine 3-DEpidermis und Inaktivierung mit gewebeverträglichem Plasma Influencing of the penetration of Pseudomonas aeruginosa into a 3-D epidermis model and the inactivation with tissue tolerable plasma. GMS Krankenhaushygiene Interdisziplinär, 2009. 4(2): p. 1 – 7.
[5.] Koban, I. and et al., Treatment of Candida albicans biofilms with low-temperature plasma induced by dielectric barrier discharge and atmospheric pressure plasma jet. New Journal of Physics, 2010. 12(7): p. 073039.
[6.] Hübner, N.O., et al., Efficacy of chlorhexidine, polihexanide and tissue-tolerable plasma against Pseudomonas aeruginosa biofilms grown on polystyrene and silicone materials. Skin Pharmacol Physiol, 2010. 23 Suppl: p. 28 – 34.
[7.] Kramer, A., et al., Perspektiven der Plasmamedizin. Vakuum in Forschung und Praxis, 2010. 22(2): p. 33 – 38.
[8.] Hammann, A., et al., Antiseptic Efficacy and Tolerance of Tissue-Tolerable Plasma Compared with Two Wound Antiseptics on Artificially Bacterially Contaminated Eyes from Commercially Slaughtered Pigs. Skin Pharmacol Physiol, 2010. 23: p. 328 – 332.
[9.] Hübner, N., et al., Antimicrobial efficacy of low-temperature plasma against 65 genetically characterized Staphylococcus aureus isolates including PVL-positive, MRSA and c-MRSA strains, in International Conference on Antimicrobial Research (ICAR2010). 2010: Valladolid (Spain).
[10.] Lademann, J., et al., Risk assessment of the application of a plasma jet in dermatology. J Biomed Opt, 2009. 14(5): p. 054025.
[11.] Bender, C., et al., The Irritation Potential of Nonthermal Atmospheric Pressure Plasma in the HET-CAM. Plasma Processes and Polymers, 2010. 7(3 – 4): p. 318 – 326.
[12] Bender, C. et al., The modified HET-CAM as a model for the assessment of the inflammatory response to tissue tolerable plasma. Toxicology in vitro, 2011. 25:p. 530 – 532]
[13.] Stoffels, E., “Tissue processing” with atmospheric plasmas. Contributions to Plasma Physics, 2007. 47(1 – 2): p. 40 – 48.
[14.] Kramer, A., et al., Chancen und Perspektiven der Plasmamedizin durch Anwendung von gewebekompatiblen Atmosphärendruckplasmen (Tissue Tolerable Plasmas, TTP) Chances and perspectives of the plasma medicine by use of Tissue Tolerable Plasma (TTP). GMS Krankenhaushygiene Interdisziplinär, 2009. 4 (2): p. 1 – 15.
Foto: © Prod. Dr. Axel Kramer
|
L&M 5 / 2011
Diese Artikel wurden veröffentlicht in Ausgabe L&M 5 / 2011.
Das komplette Heft zum kostenlosen Download finden Sie hier:
zum Download
Der Autor:
Weitere Artikel online lesen
News
Mit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!
© Text und Bild: Altmann Analytik
Aufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508
ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen.
© Text und Bild: Carl Zeiss Microscopy GmbH
|