|
Wissenschaft
 >
Ein Enzym, das die Welt veränderte
>
Ein Enzym, das die Welt veränderte
Ein Enzym, das die Welt veränderteDie Wasserspaltungsmaschine der PhotosyntheseDie Natur macht es vor: Pflanzen und andere photosynthetisch aktive Lebewesen nutzen bei der Speicherung von Energie die sonnengetriebene Spaltung von Wassermolekülen, die durch einen Metallkomplex aus Mangan, Kalzium und Sauerstoff im Protein „Photosystem II“ (PS II) katalysiert wird. Die Kenntnis dieser Reaktion könnte uns wichtige Informationen für das Design synthetischer Katalysatoren zur chemischen Energiekonversion liefern. Dieser Vorgang war einmalig: Die Evolution eines Enzyms, das die photosynthetische Spaltung von Wasser (H2O) zu Sauerstoff (O2) und chemisch gebundenem Wasserstoff katalysiert, stellte ein einschneidendes Ereignis in der Erdgeschichte und der Entwicklung des Lebens dar. Der Prozess ermöglichte es, dass Cyanobakterien, Algen und höhere Pflanzen durch oxygene Photosynthese Kohlendioxid (CO2) aufnehmen und in Kohlenhydrate umwandeln, was zum zentralen Stoffwechselweg zur Versorgung der gesamten Biosphäre sowohl mit Energie als auch Biomasse wurde. Gleichzeitig führte die Abgabe von molekularem Sauerstoff als Nebenprodukt – beginnend vor etwa 2,5 Mrd. Jahren – zur Ausbildung unserer sauerstoffreichen Atmosphäre (great oxygenation event) als Grundlage der Entstehung komplexer aerober Lebensformen mit Zellatmung während der sogenannten kambrischen Explosion. Wir Menschen profitieren von der durch Photosynthese gespeicherten Biomasse auf zweifache Weise: Sie ist Basis unserer Nahrung und deckt somit den gesamten Energiebedarf unseres Körpers. Darüber hinaus erfordert unsere moderne Zivilisation weitaus mehr Energie, die zu einem großen Teil aus fossilen Brennstoffen, ebenfalls Produkte der Photosynthese, gedeckt wird. Viele Wissenschaftler sind der Meinung, dass genau diese Abhängigkeit von einer endlichen und das Treibhausgas CO2 emittierenden Energiequelle einer weiteren revolutionären Erfindung bedarf. Die lichtgetriebene Wasserspaltung mittels eines synthetischen, im Labor entwickelten Katalysators soll es ermöglichen, Sonnenenergie chemisch in molekularen Treibstoff als langlebigem und einfach zu handhabendem regenerativen Energiespeicher – einem „solaren Brennstoff“ (solar fuel) – zu konvertieren. Ein detailliertes Verständnis der Vorgänge bei der natürlichen Wasserspaltung durch PS II auf atomarer Ebene könnte bei der Entwicklung der künstlichen Photosynthese eine enorme Hilfe sein. Die Lichtreaktionen der oxygenen Photosynthese Die Photosynthese lässt sich in zwei an unterschiedlichen Orten in der Zelle ablaufende Teilprozesse untergliedern. In den lichtabhängigen Reaktionen (kurz Lichtreaktionen) erfolgt in einer photosynthetischen Membran die Absorption elektromagnetischer Strahlung, deren Energie verwendet wird, um chemische Energieträger zu produzieren. In den lichtunabhängigen Reaktionen treiben diese wiederum die Fixierung und Reduktion von CO2 zum Aufbau von Kohlenhydraten (Zuckern) als Energiespeicher und Baumaterial an. Da PS II und die Wasseroxidation zentrale Bestandteile der Lichtreaktionen sind, wollen wir diese Vorgänge genauer betrachten. In deren Verlauf findet ein lichtgetriebener Elektronentransport verbunden mit dem Aufbau eines Protonengradienten über die Membran hinweg statt. Die beiden Pigment-Protein-Superkomplexe PS I und PS II stellen dabei zwei in Reihe geschaltete, durch Lichtenergie leicht unterschiedlicher Wellenlänge im sichtbaren Spektralbereich angetriebene Ladungsgeneratoren dar. Die absorbierten Lichtquanten initiieren jeweils hocheffizient eine Ladungstrennung in den Photosystemen, die die Ladungen innerhalb von Picosekunden extrem schnell weiter separieren, um die Rückreaktion und damit Energieverluste zu verhindern. Der Ladungstransfer erfolgt dabei über redoxaktive Aminosäuren und Kofaktoren, d.h. mit den Proteinen assoziierte Moleküle. Neben den Photosystemen sind mit dem Cytochrom-b6f-Komplex ein weiterer Transmembranproteinkomplex sowie mehrere kleinere, z.T. in der Membran mobile Elektronentransporter an der Weiterleitung beteiligt. Die transportierten Elektronen (e-) stammen aus dem vom PS II oxidierten Wasser am Anfang der Kette und dienen schließlich auf der anderen Membranseite dazu, das Koenzym Nicotinsäureamid-Adenin-Dinukleotid-Phosphat in seine reduzierte Form (NADPH) zu versetzen. NADPH wird auch als „biologischer Wasserstoff“ bezeichnet. Zwei Photosysteme sind dabei nötig, um die enorme Potenzialdifferenz (Energiespanne) abzudecken, die für die angekoppelten chemischen Reaktionen notwendig ist. Da mit diesen Reaktionen auch ein Protonentransport über die Membran hinweg einhergeht, kommt es zur Ausbildung eines Protonengradienten. Das Enzym ATP-Synthase, ein weiterer Transmembranproteinkomplex, ermöglicht den Protonen die Rückwanderung entlang des Gradienten. Dabei nutzt es deren elektrochemisches Potenzial, indem es die darin gespeicherte Energie zur Synthese von Adenosintriphosphat (ATP) verwendet. Die beiden Stoffe ATP und NADPH sind die energetischen Währungen der Zelle. Sie liefern die Energie für die Reduktion von CO2 und dessen Bindung in Form von Kohlenhydraten in den lichtunabhängigen Reaktionen des Calvin-Zyklus.
Abb.1 Die Vorgänge im PS II bei der natürlichen Photosynthese und in einer synthetischen katalytischen Einheit zur künstlichen Photosynthese im schematischen Vergleich. Beide beinhalten Lichtabsorption, Ladungstrennung und -transport, Wasseroxidation und finale Elektronenakzeptoren. Dies sind Chinone im PS II, die durch Aufnahme von 2 e- und 2 Protonen (H+) Wasserstoff chemisch binden, bzw. Protonen im synthetischen Katalysator, dessen Produkt H2 direkt in Brennstoffzellen oder zur Synthese verschiedener Flüssigtreibstoffe und anderer wichtiger Stoffe wie NH3 eingesetzt werden kann.
Photosystem II und der wasseroxidierende Komplex Im PS II sind alle für Ladungstrennung und Elektronentransport verantwortlichen, also redoxaktiven Komponenten (P680, Phäo, QA, Fe2+, QB, Tyrosin YZ, Mn4OxCa) mit den zwei zentralen Untereinheiten D1 und D2 im Reaktionszentrum (RZ) assoziiert (Abb. 1, links). Der anorganische wasseroxidierende Komplex (WOC) aus vier Mangan- und einem Kalziumion, die über vier bis sechs Sauerstoffbrücken verbunden sind (Mn4OxCa), ist über spezifische Kanäle für die effiziente Zufuhr von Wasser und die Abgabe von Sauerstoff und Protonen mit der Proteinoberfläche verbunden. Die Reaktionsabläufe im PS II lassen sich wie folgt unterteilen (für Details siehe z.B. [1]):
1. Lichtabsorption durch Antennen- oder Lichtsammelpigmente und Energie-transfer zu den D1/D2-Untereinheiten des RZ (Exzitonentransferprozess). In der Summe überträgt PS II also Elektronen von Wasser auf das Chinon („Wasser: Plastochinon-Oxidoreduktase“). Als Produkte werden O2 freigesetzt sowie Protonen und PQH2 ans Medium bzw. in die Membran abgegeben. Dieser lichtgetriebene Prozess verläuft höchst effizient mit einer Quantenausbeute von etwa 90% und einer Energieeffizienz von ca. 20%. Der Mn4OxCa-Cluster des WOC hat die Funktion des Katalysators der Wasserspaltung, und dabei zugleich die eines Zwischenspeichers für positive Ladungen („Oxidationsäquivalente“). Bei der Oxidation von Wasser zu einem Molekül O2 müssen zwei H2O-Molekülen vier Elektronen entzogen werden. Sowohl aus energetischen Gründen als auch um das Auftreten reaktiver Sauerstoffspezies zu verhindern, kann diese Reaktion nicht als Abfolge sukzessiver Schritte von Ein-Elektronen-Oxidationen der H2O-Moleküle erfolgen. Stattdessen werden die Mn-Ionen (und/oder deren Liganden) viermal in Folge jeweils nach Lichtabsorption und einer Ladungstrennung durch den redoxaktiven Aminosäurerest YZ oxidiert, bevor der Cluster in einer konzertierten Aktion den beiden H2O-Molekülen vier Elektronen auf einmal entzieht und dadurch selbst wieder reduziert wird. Somit wirkt er als Schnittstelle, die zwischen der Ein-Elektronen-Redoxchemie der Pigment-Kofaktoren und der Vier-Elektronen-Chemie der Wasseroxidation vermittelt. Dieses Prinzip wurde bereits 1970 von Bessel Kok (Research Institute for Advanced Studies, Baltimore) basierend auf Beobachtungen der blitzinduzierten O2-Freisetzung durch Pierre Joliot (Collège de France, Paris) formuliert. Seither ist die von ihm eingeführte Bezeichnung der fünf Oxidationszustände des Clusters als Si-Zustände gebräuchlich, wobei i = 0 – 4 die Anzahl der gespeicherten Oxidationsäquivalente angibt. Während der vier ersten Schritte von S0 nach S4 binden die beiden Substratmoleküle zeitlich versetzt und räumlich getrennt an definierten, nah beieinander liegenden Stellen im Metall-Cluster und werden im weiteren Verlauf deprotoniert. Bei ihrer Oxidation während des Übergangs von S4 nach S0 wird dann die O-O-Bindung gebildet und schließlich O2 freigesetzt. Der gesamte Zyklus wird innerhalb von ca. 2ms durchlaufen – entsprechend einer Umsatzrate von 500 s-1.
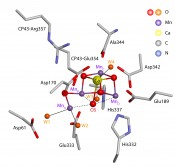
Abb.2 Der WOC in der Röntgenkristallstruktur des PS II im S1-Zustand [4]. Gezeigt sind der anorganische Mn4OxCa-Cluster mit den vier gebundenen Wassermolekülen W1 bis W4 sowie die umliegenden Aminosäurereste.
Die räumliche Struktur des Mn4OxCa-Clusters Das mechanistische Verständnis eines dynamischen Prozesses wie der katalytischen Oxidation zweier H2O-Moleküle erfordert die Kenntnis der räumlichen Strukturen aller durchlaufenen Zustände des Komplexes aus Katalysator und Reaktanten. Mittels konventioneller Röntgenkristallografie ist es jedoch aufgrund der bei den eingesetzten intensiven Dosen entstehenden Strahlungsschäden, insbesondere am Mn4OxCa-Cluster, nicht möglich, die Struktur eines klar definierten S-Zustandes zu erhalten. Selbst bei sehr tiefen Temperaturen führen die von modernen Elektronenbeschleunigern (Synchrotrons) erzeugten intensiven Röntgendosen zur Photoreduktion der Mn-Ionen, was mit gravierenden strukturellen Veränderungen verbunden ist [2]. Darüber hinaus erreichten die ersten PS II-Strukturen keine atomare Auflösung, bis es einer japanischen Gruppe um Jian-Ren Shen (Okayama University) 2011 schließlich gelang, den Proteinkomplex mit einer Auflösung von 1.9 Å zu kristallisieren [3]. Mit der jüngsten Entwicklung von Röntgenlasern, d.?h. Freier-Elektronen-Laser im Röntgenbereich (XFEL), lassen sich mittlerweile mit Femtosekunden-Röntgenpulsen Beugungsmuster eines Proteins aufnehmen. Obwohl die immensen Strahlungsenergien zur Zerstörung der Kristalle führen, erhält man dennoch eine Proteinstruktur, die nahezu frei von strahlungsinduzierten Schäden ist („diffraction before destruction“). Shen und Mitarbeiter präsentierten Anfang des Jahres eine auf diese Weise ermittelte PS II-Struktur mit noch weniger Strahlungsschäden bei einer Auflösung von 1.95 Å [4]. Diese Röntgenstruktur des S1-Zustands (Abb. 2) zeigt, dass der anorganische Cluster eine verzerrte, annähernd würfelförmige Mn3O4Ca-Einheit beinhaltet, bei denen die vier Metallionen (MnB, MnC, MnD, Ca2+) an den Ecken sowie die anderen vier Ecken aus verbrückenden Sauer-stoffliganden jeweils einen Tetraeder bilden. Das vierte Mn-Ion, MnA, ist über eine weitere O-Brücke (µ-oxo) mit MnB im Kubus verbunden. Der Cluster ist im Protein über Aminosäurereste verankert, wobei Sauerstoffe von sechs Carboxylaten und ein Histidin-Stickstoff als Liganden an die Metallionen binden. Außerdem finden sich vier Wasser-/Hydroxid-Moleküle als Liganden, jeweils zwei am MnA und am Ca. Diese sind natürlich potentielle Kandidaten für die Substratwassermoleküle. Kürzlich wurden von den Gruppen um Petra Fromme (Arizona State University) [5] und Junko Yano und Vittal Yachandra (Lawrence Berkeley National Laboratory) [6] ebenfalls mittels Röntgenbeugung an einem XFEL (SLAC, Stanford) Kristallstrukturen von PS II in weiteren S-Zuständen gelöst. Gekoppelt mit Lasern im sichtbaren Spektralbereich lassen sich gezielt Zustände von S2 bis S0 in Mikrokristallen erzeugen. Allerdings lässt die relativ niedrige Auslösung (>4.5 Å) noch keine Rückschlüsse auf relevante strukturelle Veränderungen im Vergleich zu S1 zu. Die ultrakurzen Röntgenpulse ermöglichen zeitaufgelöste Messungen von strukturellen Prozessen bis in den Femtosekundenbereich. Diese könnten zukünftig Bilder liefern, die den Katalysezyklus zeigen und auch den transienten S4-Zustand und die O-O-Bindungsbildung auflösen.
Abb.3 EPR-Spektrum des Mn4OxCa-Clusters im S3-Zustand, gemessen bei einer Mikrowellenfrequenz von 94 GHz (W-Band), und quantenmechanische Simulation der Übergänge zwischen den Spineinstellungen MS. Die Analyse und weitere Experimente zeigen eindeutig, dass der S3-Zustand einen Gesamtspin 3 (entsprechend sechs ungepaarten Elektronen) besitzt und als ein MnIV4-Zustand beschrieben werden muss.
Die elektronische Struktur des Mn4OxCa-Clusters Ein umfassendes Verständnis des katalytischen Prozesses erfordert neben der räumlichen Struktur sowie der Kinetik und Energetik auch die genaue Kenntnis der elektronischen Struktur, also der Verteilung der Elektronen im Mn4OxCa-Cluster, in den verschiedenen Reaktionsphasen. Eine vereinfachende Beschreibung liefern die Oxidations- und Spinzustände der Mn-Ionen, die die Gesamtanzahl der Elektronen in den Mn-Orbitalen bzw. ihre Verteilung darauf angeben. Zusammen mit den Wechselwirkungen zwischen den spintragenden Mn-Ionen, die wesentlich von den Metall-Liganden, insbesondere den verbrückenden Liganden, bestimmt werden, ergeben sie ein Gesamtbild des Elektronenzustands, der maßgeblich die chemischen und katalytischen Eigenschaften eines S-Zustands bestimmt. Experimentell lassen sich die entsprechenden Parameter mit der paramagnetischen Elektronenresonanz-Spektroskopie (EPR, engl.: electron paramagnetic resonance) untersuchen. Diese beruht auf den Eigendrehimpulsen (Spins) von ungepaarten Elektronen, die in einem Magnetfeld durch Mikrowellenstrahlung anregt werden, und deren Wechselwirkungen miteinander und mit den Spins von Kernen. Da die Mn-Ionen offene Elektronenschalen, also Orbitale mit einzelnen Elektronen, besitzen, während die allermeisten Elektronen der Protein- und Lösemittelumgebung gepaart vorliegen, lassen sich die Signale des Mn4OxCa-Clusters gezielt detektieren. EPR-Experimente zeigen für die Zustände S0, S1, S2 und S3 unterschiedliche Gesamtspins von ½, 0, ½ und 3 [7] (Abb. 3), die sich durch Interaktion der Elektronenspins der vier Mn-Ionen ergeben. Im S2-Zustand kann der Cluster auch in einer Hochspin-Form (5/2) vorliegen, erkennbar am entsprechenden EPR-Signal. Die zwei elektronischen Strukturen sind unmittelbare Folge unterschiedlicher räumlicher S2-Konformationen (Abb. 4), „geschlossen“ (5/2) und „offen“ (½) [8]. Ferner wechselwirken die Elektronenspins, deren Spindichte über den Cluster delokalisiert ist, auch mit den Spins von Atomkernen wie 55Mn, 1H, 14N oder 17O. Bei der Interpretation dieser Wechselwirkungen helfen Doppelresonanzexperimente, bei denen Kernspinresonanzen wie in der verwandten NMR (engl.: nuclear magnetic resonance) direkt aufgelöst werden. Dadurch konnten die Oxidationszustände MnIII3MnIV, MnIIIMnIV3 bzw. MnIV4 für S0, S2 und S3 bestimmt werden. Selbst die Zuordnung zu den einzelnen Mn-Ionen im Cluster war möglich (Abb.4). Über den Oxidationszustand lassen sich z.B. Aussagen zu Anordnung und Zahl der Liganden (Koordinationsgeometrie) und dadurch zu möglichen Bindestellen von Substratwasser treffen.
Abb.4 Mechanismus der photosynthetischen Wasserspaltung durch den Mn4OxCa-Cluster, basierend auf der Röntgenkristallstruktur, massenspektrometrischen und EPR-spektroskopischen Daten sowie quantenmechanischen Berechnungen.
Von der Identifikation der Substratwassermoleküle zum Reaktionsmechanismus Zur Formulierung des Reaktionsmechanismus ist es notwendig, die Bindung der Substratwassermoleküle und ihre Dynamik zu kennen. Die vorhandenen Röntgenstrukturen vermitteln dies jedoch nicht, da sie in den Zuständen kurz vor der O-O-Bindungsbildung die Substrate nicht auflösen. Der S1-Zustand zeigt die vier direkt an den Cluster gebundenen H2O/OH--Moleküle. Außer diesen kommen aber auch deprotonierte Wassermoleküle in Form von O-Brücken sowie ein potenziell später bindendes Wasser infrage. Andere Techniken zur Untersuchung der Substrate sind EPR- und Schwingungs-(Infrarot-)Spektroskopie sowie zeitauflösende Massenspektrometrie (MS) der produzierten O2-Moleküle. Letztere zeigte, dass die beiden Substratmoleküle in verschiedenen S-Zuständen und an unterschiedliche Stellen binden [9]. Ein langsam austauschendes Wasser Ws bindet in S0, während ein schnell austauschendes Wasser Wf erst später im Zyklus an seiner endgültigen Stelle bindet. Die EPR-Spektroskopie macht sich zur Detektion von Wassermolekülen im WOC die Wechselwirkung mit Kernspins, bevorzugt 17O in Proben mit Isotopen-markiertem H217O als Lösungsmittel, zunutze. Methodische und instrumentelle Entwicklungen in unserem Labor erlaubten uns die Identifikation der µ-oxo-Brücke O5 (Abb. 4) als austauschbaren Liganden im S2-Zustand. Aus folgenden Gründen ist dies der wahrscheinlichste Kandidat für das zweifach deprotonierte Ws [10]: (I) Es ist der einzige sowohl Mn- als auch Ca-gebundene austauschbare 17O-Kern, wie durch MS für Ws gezeigt. (II) Ähnliche Zeitskalen des Austauschs wurden für Ws in den MS- und für O5 in den EPR-Experimenten gefunden. Das später bindende Substrat wurde experimentell noch nicht direkt identifiziert, jedoch legen neueste EPR-Daten nahe, dass ein OH- im S3-Zustand an MnD gebunden ist (Abb. 3). Ob es sich beim späten Substrat um einen der in S2 an MnA (s. S3’ in Abb. 4) oder Ca gebundenen Liganden oder um ein zusätzliches Wasser-Molekül handelt, ist derzeit noch unklar. Für die enzymatische Wasseroxidation bedeutet das, dass nur Mechanismen infrage kommen, in denen O5 dem Ws entspricht (Abb.4). Es bindet vermutlich unter Deprotonierung im S0-Zustand und wird im Zuge des nächsten Oxidationsschritts vollständig deprotoniert. Während der Bildung von S3 bindet Wf als OH- an MnD. Ein weiterer kombinierter Oxidations- und Deprotonierungsschritt führt zu S4. Für den Ort der Oxidation kommen prinzipiell zwei Szenarien in Betracht, (I) das Substrat Wf (ligandzentriert) oder (II) ein Mn-Ion (metallzentriert). Dadurch würde eine MnIV-oxyl- bzw. eine MnV-oxo-Gruppe entstehen, und die O-O-Bindungsbildung würde entweder als radikalische Kopplung oder als nukleophiler Angriff erfolgen. Eine oxyl-oxo-Kopplung ist bereits vor fast zehn Jahren von Per Siegbahn (Stockholm University) vorgeschlagen worden (s. [11]). Abb.4 zeigt die Details des Wasserspaltungszyklus. Wasserspaltung zur regenerativen Energiegewinnung: Künstliche Photosynthese Die Erkenntnisse zur photosynthetischen Wasseroxidation durch PS II sind von grundlegender Bedeutung auch für eine mögliche industrielle regenerative Energiegewinnung. Dabei geht es jedoch nicht darum, den WOC und womöglich die ihn umgebende Proteinmatrix strukturell nachzuahmen, sondern vielmehr sollen grundlegende Prinzipien des in der Natur über Jahrmillionen perfektionierten Systems erkannt werden und als Basis für die Synthese von Wasserspaltungskatalysatoren dienen (Abb.1). Folgende Merkmale des PS II schätzen wir dabei als essenziell ein:
I. Katalysatormaterial: häufig vorkommend, einfach zugänglich, preislich günstig, nicht toxisch, stabil Diese Anforderungen zu vereinen stellt eine große Herausforderung für die Chemie bei der Suche nach einem stabilen und in großem Maßstab anwendbaren Katalysator zur lichtinduzierten Wasserspaltung dar. Trotz enormer Fortschritte in den letzten Jahren ist bisher kein System entwickelt worden, das den Anforderungen genügt.
Literatur Bild: istockphoto.com, aLittleSilhouetto |
L&M 8 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |