|
Chemie
 >
Von den Anwendungen in den molekularen Biowissenschaften und der Biotechnologie bis zur Erforschung der Grenzen des Lebens
>
Von den Anwendungen in den molekularen Biowissenschaften und der Biotechnologie bis zur Erforschung der Grenzen des Lebens
Von den Anwendungen in den molekularen Biowissenschaften und der Biotechnologie bis zur Erforschung der Grenzen des LebensChemie unter DruckLeben unter extremen Bedingungen
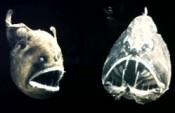
Das zunehmende Interesse an der Erforschung neuartiger Lebensräume, die vorher oftmals als unbewohnbar galten – von den heißen Quellen der Tiefsee, den Permafrost regionen in der Antarktis und Gesteinsschichten Kilometer unter dem Tiefseeboden bis zu den streng riechenden brodelnden Solfatarenfeldern im Yellowstone Park oder auf Island (Abb. 1) [1 – 5] – fasziniert auch immer mehr Chemiker und Ingenieure. Tiefseeorganismen leben bei tiefen Temperaturen von einigen Grad Celsius und unter Bedingungen bis zu 110 bar (110 MPa) an den tiefsten Stellen unserer Ozeane (Abb. 2). Immerhin sind 70 % der Erdoberfläche von Ozeanen bedeckt, deren durchschnittliche Tiefe 3800 m beträgt, d. h., wo Drücke von fast 400 bar herrschen (pro 10 m Wassertiefe erfolgt ein Druckanstieg von etwa 1 bar). Im Gegensatz zum Menschen tolerieren viele Tiefseefische und Mikroorganismen sog bar. Besonders spektakuläre Bio tope stellen die Heißwasserkamine in der Tiefsee dar („Schwarze Raucher“), die sich an den Nahtstellen der sich übereinanderschiebenden oder auseinanderdriftenden Kontinentalplatten bilden. Sie stoßen bis zu 400 °C heißes, stark mineralhaltiges Wasser in das etwas 3 °C kalte Meerwasser aus und schaffen Zonen unterschiedlichster Temperatur und unterschiedlichsten Lebens. Kommt unser erster Vorfahre LUCA (Last Universal Common Ancestor) aus der Tiefsee, wo unter erhöhtem Druck, abgeschirmt von der extremen
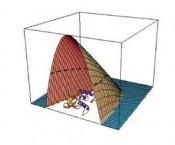
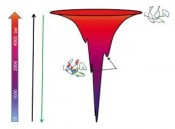
Strahlung auf der frühen Erdoberfläche, evtl. unter Zuhilfenahme katalytischer RNA, erste Lebensformen entstanden? Vieles scheint dafür zu sprechen, z. B. eine erhöhte Toleranz gegenüber erhöhten Drücken, die in allen Domänen des Lebens gefunden wurden [3]. Mit direkten Evolutionsstrategien gelang es kürzlich, sogar in mesophilen Bakterien wie E. Coli Überlebensstrategien zu induzieren, die sie gegen hohe Drücke bis in den 10 kbar (1 GPa)-Bereich resistent machen [6]. Bislang gibt es nur vage Vorstellungen darüber, wie sich die Anpassung dieser Organismen an Bedingungen erhöhten Drucks vollzieht. Mit die drucksensitivsten biomolekularen Teilsysteme sind die biologischen Membranen. Man fand z. B. heraus, dass die Membranen von Tiefseeorganismen einen höheren Anteil ungesättigter Fettsäuren enthalten, um die Fluidität ihrer Membranen aufrechterhalten zu können [3]. Die Biosynthese von Lipiden kann sich den Umweltbedingungen anpassen. Lernen von Extremophilen – neuartige biotechnologische Prozesse Die speziellen Eigenschaften von Tiefseebakterien wie Piezophilie und Psychrophilie, d.h. die Vorliebe für Druck- und Kälteumgebung, aber auch die Thermophilie von Isolaten aus hydrothermalen Quellen, lassen diese Organismen auch interessant für die Biotechnologie erscheinen. Ihre stärkere Aktivität unter Extrembedingungen hat Enzymen thermophiler Mikroben bereits zu einem eindrucksvollen Debüt verholfen [2,3,7]. Die hyperthermophilen Archaea haben extrem hitzestabile DNAPolymerasen, die jede beliebige DNA vervielfältigen. Am Anfang stand das Enzym Taq-DNA-Polymerase aus dem hyperthermophilen Bakterium Thermus aquaticus, das Thomas Brock aus den heißen Quellen im Yellowstone-Nationalpark isoliert hatte, und das die Ära der Polymerase-Kettenreaktion einleitete. Die Erforschung und Nutzung der Enzyme solcher „Extremozyme“ hat gerade erst begonnen. Gewöhnliche kommerziell eingesetzte Enzyme sind wie die meisten Proteine gegenüber hohen Temperaturen und anderen harschen Bedingungen empfindlich. Damit sie stabil bleiben, sind für ihre Lagerung und Anwendung meist sehr aufwändige und damit teure Vorkehrungen zu treffen. Mit widerstandsfähigen, diesen Aufwand nicht erfordernden Pendants aus extremophilen Organismen kann man etablierte Verfahren oftmals kostengünstiger und gleichzeitig effizienter machen sowie unter Umständen völlig neue konzipieren. Erprobte Beispiele liegen etwa im Bereich der Waschmittelzusätze. Welchen strukturellen Charakteristika für eine hohe Temperatur- und Druckresistenz von Proteinen verantwortlich zeichnen, ist noch weitgehend unerforscht. Die wenigen Vergleiche ähnlich arbeitender Proteine aus mesophilen und thermophilen oder barophilen Organismen zeigen noch keine eindeutigen Hinweise. Was jedoch inzwischen klar ist, ist, dass die strukturellen Unterschiede wie z. B. eine höhere Anzahl ionischer Wechselwirkungen, eine Stabilisierung durch Metallionen (wie Ca2+) oder zusätzliche Disulfidbrücken gering sind. Bekannt ist weiterhin, dass Tiefseeorganismen gerne Osmolyte im Zellinneren nutzen wie das Trimethyl-NOxid, das sogar als „Piezolyt“ bezeichnet wird. Es wirkt der druckinduzierten Änderung der Wasserstruktur entgegen [8]. Vermutlich besitzen diese Organismen auch andere Stresskontrollelemente und metabolische Prozesse. Vielleicht könnten diese für die Gewinnung neuer Sekundärprodukte in biotechnologischen Verfahren von Nutzen sein. Auch die biotechnologisch orientierten Verfahrenstechniker, die ja gerne mal Temperatur, Lösungsmittel und den pH-Wert ändern, widmen sich zunehmend dem Parameter Druck, um Prozessführung und Ausbeute zu optimieren [7,9]. Im Vordergrund stehen dabei wieder enzymkatalysierte Reaktionen. Die Geschwindigkeit enzymgesteuerter Prozesse ist oftmals durch die Hitzesensitivität des Enzyms beschränkt. Diese lässt sich jedoch oftmals durch milde Drücke (< 2 kbar) erhöhen, sodass eine schnellere Umsetzung des Substrats bei höheren Temperaturen möglich wird. Auch die Substratspezifität und Enantioselektivität lassen sich manchmal durch Druck beeinflussen. Man hat in vielen Fällen auch eine Erhöhung der Turnover-Rate bei erhöhtem Druck von einigen 100 bis 1000 bar beobachtet. Wenn der Druck jedoch zu hoch ist, setzt die Denaturierung und Inaktivierung der Enzyme ein. Die größte Expertise liegt bislang im Bereich Hochdruck-Lebensmitteltechnologie vor [7,10]. Hier stand das Frühstücksei, das der spätere Physik-Nobelpreisträger P. W. Bridgman (1882 – 1961) unter Druck setzte, am Anfang. Nach kurzer Behandlung bei 7 kbar beobachtete er, dass das Ei so hart wie gekocht war. Dieses 1914 publizierte Experiment begründete sowohl die Hochdruckbiochemie der Proteine als auch die Behandlung von Lebensmitteln mit hohen Drücken, denn unter hohem Druck lassen sich nicht nur Proteine denaturieren, eine Druckbehandlung ist auch schonender, da unerwünschte Nebenreaktionen, die bei der Haltbarmachung von Lebensmitteln durch Hitze auftreten (wie Maillard-Reaktionen), ausbleiben. Außer der proteindenaturierenden Wirkung machen sich Lebensmitteltechnologen auch andere Effekte des Drucks zu Nutze wie das Abtöten von Mikroorganismen (zur Konservierung von Lebensmitteln), das Gelatinieren von Stärke (was z. B. bei der Bereitung von Marmeladen erwünscht ist), Texturänderungen (z. B. beim Fleisch) und die Inaktivierung von Enzymen, die unerwünschte Reaktionen auslösen könnten (z. B. Allergene). Seit 1990 sind in Japan verschiedene Hochdruckprodukte auf dem Markt, die ohne jegliche Temperaturbehandlung hergestellt werden: Gemüse, Säfte, Fleisch, Fisch, Reis, Milchprodukte, Tee und Kaffee. Diese „gedrückten“ Produkte kommen in Farbe und Geschmack den unbehandelten Produkten näher als auf konventionelle Weise gekochte Produkte. In zunehmendem Maße hält die Hochdruck-Lebensmitteltechnologie auch in Europa Einzug. Auch in der Prozessentwicklung am Deutschen Institut für Lebensmitteltechnik in Quakenbrück ist der Druck kein Unbekannter mehr. Oftmals werden auch Kombinationen von Druck und Temperaturbehandlung diskutiert, etwa die Abtötung bakterieller Sporen durch einige kbar Druck bei mäßig erhöhten Temperaturen oder die Konservierung bei Temperaturen unter dem Nullpunkt der Celsius-Skala, wobei der Druck die Eisbildung verhindert und ein schonenderes Auftauen oder Einfrieren ermöglicht. Druck in den molekularen Biowissenschaften Untersuchungen von Druckeffekten auf biochemische Reaktionen haben in Deutschland eine lange Tradition [1]. Generell bevorzugt hoher Druck nach dem Prinzip des kleinsten Zwanges von Le Châtelier Zustände, bei denen das Gesamtvolumen des Biomolekül-Lösungsmittel-Systems abnimmt. Während man bei einer Temperaturänderung die thermische Energie und die Dichte des Systems gleichzeitig ändert, ändert man in Druckexperimenten nur die Dichte. Durch Anwendung beider Parameter lassen sich somit beide Effekte trennen. Durch Druckanwendung lässt sich auch die intermolekulare Wechselwirkung modulieren: Hydrophobe Wechselwirkungen werden destabilisiert und H-Brückenbindungen verstärkt. Anders als eine Temperaturerhöhung ist der Druck ein sehr milder Störparameter: Selbst Drücke von einigen 1000 bar ändern die Energetik lediglich um wenige kJ/mol. Man erhält thermodynamische und – über Drucksprungexperimente – kinetische Informationen über den Prozess und bestimmt Reaktions- bzw. Aktivierungsvolumina von Reaktionen, aus denen sich dann wertvolle Rückschlüsse auf die Beiträge der verschiedenen Wechselwirkungen und den Mechanismus der Reaktion ableiten lassen. Druckzellen für Laborexperimente wurden in den letzten Jahren für fast alle spektroskopischen, mikroskopischen und Streumethoden entwickelt (s. z. B. Abb. 5). Im Bereich biologisch relevanter Fragestellungen haben sich die Arbeitsgruppen meist um Druckeffekte auf überschaubare Systeme wie Modellbiomembranen, Proteine und DNA sowie einfache biochemische Reaktionen gekümmert [1,3,11 – 15]. Die Anwendung von hohem Druck lieferte z. B. wichtige Details über Proteine wie Stabilitätsgrenzen (Abb. 3), die Struktur von Faltungsintermediaten, die Existenz von Konformationsgleichgewichten (Abb. 4) sowie über den Selbstassemblierungsprozess zu Aggregatstrukturen. Proteinaggregate sind drucksensitiv, da sie meist Packungsdefekte aufweisen. So konnten durch Druck präamyloide Konformationen von Proteinen wie des Prionenproteins charakterisiert werden. Die Infektivität des Prionenproteins PrPSc lässt sich durch eine Kombination hoher Drücke und Temperaturen drastisch reduzieren. Es lassen sich aber auch Inclusion bodies nach Expression rekombinanter Proteine auflösen, sodass wertvolle therapeutische Proteine in ihre native Form rückgefaltet werden können. Eine weitere Anwendung ist darauf zurückzuführen, dass eine Druckänderung sich umso stärker auf das Konformationsgleichgewicht von Proteinzuständen auswirkt, je mehr sich die Zustände in ihrer effektiven „Packungsdichte“ und damit in ihrem Volumen unterscheiden. Dies lässt sich z. B. nutzen, um neue funktionale Konformationszustände von Proteinen zu erkunden wie etwa diejenigen der multifunktionalen Signalproteine [15]. Was ist in Zukunft zu erwarten? Eine der interessantesten industriellen Hoch druckanwendungen – neben der Lebensmitteltechnologie – dürfte in der Steuerung mikrobieller Fermentationsprozesse und enzymatischer Reaktionen liegen, dann aber auch im Bereich medizinischer, kosmetischer und pharmakologischer Anwendungen. Die technischen Probleme scheinen weitgehend gelöst zu sein, da Drücke im 8 kbar-Bereich in der Lebensmittelindustrie heute schon keine große Herausforderung mehr darstellen. Man darf gespannt sein, was der noch anstehende intensivere Wissensaustausch zwischen Hochdruck- Biochemikern, -Molekularbiologen und -Biophysikern einerseits und Hochdruck-Biotechnologen und Verfahrenstechnikern andererseits an neuen Ideen hervorbringen wird. Auf unserem Gebiet, den Anwendungen hohen Drucks in den molekularen Biowissenschaften, wird man sich komplexeren Systemen widmen. Mithilfe von Druckperturbations-Experimenten wird man versuchen, neue biosynthetische Wege zu erschließen, die vielleicht zur Bildung neuer Produktvarianten führen. Die Beeinflussung metabolischer Wege oder allgemein biologischer Netzwerke durch Druck ist ein interessanter Ansatz, der auch in der Systembiologie zu neuartigen Erkenntnissen über die Dynamik zellulärer Prozesse und Signalprozesse führen könnte. All dies wird natürlich auch helfen, die Grenzen des Lebens unter Extrembedingungen aufzuspüren. Literatur beim Autor Foto: © Prof. Dr. Roland Winter |
L&M 5 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |