|
Forscher
>
Prof. Dr. Dario Anselmetti
>
DNA-Protein-Interaktionen auf Einzelmolekülniveau
DNA-Protein-Interaktionen auf EinzelmolekülniveauBiomoleküle - Kräfte
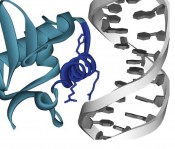
Prof. Dr. N. Sewald, Prof. Dr. D. Anselmetti und Biomoleküle wie Proteine und DNA sind aufgrund ihrer Dimensionen Nano-Objekte, wobei Enzyme analog dazu als Nano- Maschinen betrachtet werden können. Moderne Methoden aus dem Bereich der Nanotechnologie erlauben es seit wenigen Jahren, die molekulare Erkennung direkt an solchen Nano-Objekten und damit an einzelnen Molekülen zu untersuchen [1]. Einzelmolekülexperimente betrachten individuelles Verhalten von Molekülen und sind so in der Lage, ein quantitatives und detailliertes Bild über die Energien von zwischenmolekularen Wechselwirkungen zu generieren. Dabei ist alleine schon die Vorstellung faszinierend, die Kräfte der Interaktion zwischen zwei einzelnen Molekülen zu untersuchen. Mit den modernen biophysikalischen Methoden der Kraftspektroskopie und der Optischen Pinzette wird die Interaktionskraft zweier Moleküle direkt messbar. Die bislang in den Lebenswissenschaften verwendeten Untersuchungsmethoden liefern im Gegensatz dazu gemittelte Informationen über ein Ensemble von Molekülen. DNA-Protein Wechselwirkungen spielen bei einer Vielzahl von Ereignissen wie z.B. der Transkription, Replikation oder DNA-Reparatur eine wichtige Rolle. Die Genexpression wird durch die spezifische Bindung von Transkriptionsfaktoren an Kontrollregionen der DNA reguliert. Durch Wechselwirkung mit der RNA-Polymerase wird anschließend die Transkription initiiert, so dass die Zelle auf Umweltreize reagieren und die jeweils benötigten Proteine produzieren kann. Daher ist es von großem Interesse, neue Erkenntnisse über die molekulare Erkennung zu erhalten und für die spezifische Komplexbildung und Sequenzspezifität essentielle Aminosäurenreste von Proteinen zu identifizieren [1,2]. Mit Hilfe der Rasterkraftmikroskopie und der Dynamischen Kraftspektroskopie wurde die molekulare Erkennung von DNA durch Proteine untersucht. Dazu wird die DNA an einer mikroskopisch kleinen Spitze befestigt und an eine mit Proteinen funktionalisierte Oberfläche angenähert bis eine Bindung zwischen zwei einzelnen Molekülen erfolgt (Abb. 1A). Beim Zurückziehen lässt sich das Reißen einzelner Bindungen beobachten (Abb. 1B). Aus der Verbiegung der an der Spitze befestigten Balkenfeder (cantilever) lässt sich die benötigte Kraft berechnen, woraus sich dann Rückschlüsse auf die molekularen Vorgänge des Bindungsprozesses ziehen lassen. Die Methode hat eine sehr hohe Auflösung, da Kräfte bis in den Piconewton-Bereich (10-12N) gemessen werden können und so die Kräfte der Bindung eines einzelnen Proteins an die DNA detektiert werden können. Zudem kann durch Variation der Ziehgeschwindigkeit im Rahmen der Dynamischen Kraftspektroskopie auch Information über die Dissoziationskinetik des Komplexes (koff) sowie der Bindungsenergielandschaft gewonnen werden. Die Korrelation von Daten aus Einzelmolekülexperimenten mit makroskopischen Ensembledaten ist ein wichtiger Schritt bei der Bewertung der Einzelmoleküldaten. Oberflächenplasmonresonanz (surface plasmon resonance, SPR) ist ein hochsensitives Verfahren zur Untersuchung der Interaktion zweier Biomoleküle im Ensemble. Wichtige Vorteile sind, dass die Proteine nicht markiert werden müssen und geringe Mengen Probensubstanz ausreichend sind. Einer der beiden Interaktionspartner wird auf der Oberfläche eines Sensorchips immobilisiert, der zweite Interaktionspartner wird in Lösung über die Oberfläche geleitet. Die Massenänderung durch die Assoziation wird detektiert und Assoziation wie Dissoziation können in Echtzeit verfolgt werden. Die Daten können zur Bestimmung von Bindungsparametern verwendet werden. Als Modellsystem für die Untersuchungen diente die DNA-bindende Domäne (DBD) des Transkriptionsfaktor PhoB aus Escherichia coli [2]. Dabei wurden sowohl funktionelle Studien mit der DNA-bindenden Domäne als auch mit kürzeren Peptidepitopen durchgeführt, um Aussagen über die Rolle einzelner Aminosäurereste und Sekundärstrukturelemente bei der DNA-Bindung treffen zu können. Die chemische Festphasenpeptidsynthese oder alternativ die Proteinexpression in Bakterien ermöglichen es, massgeschneidert kleinere und größere Epitope eines Proteins herzustellen und selektiv zu funktionalisieren. Röntgenstrukturanalysen und NMRUntersuchungen des Proteins unterstützten die Auswahl geeigneter Epitope.
Im Fokus dieser Untersuchungen stand die vollständige DBD PhoB(126-229) (Abb. 2) und das 20 Aminosäuren lange Epitop PhoB(190-209) (Abb. 3). Letzteres bildet in der DNA-bindenden Domäne von PhoB eine amphiphile α-Helix, die für die Bindung an DNA verantwortlich ist. Durch den Austausch einzelner basischer Aminosäuren wurde der Beitrag dieser Seitenketten an der molekularen Erkennung untersucht [3,4]. Kraftspektroskopie und Oberflächenplasmonresonanz wurden zur Untersuchung von Proteinepitopen und Punktmutanten unterschiedlicher Länge einge- setzt. Die DNA-Komplexe des Proteins zeigten im Vergleich zu dem Peptid aus dem Bereich der amphiphilen á-Helix PhoB(190-209) eine etwa 1000-fach längere Lebensdauer. Das Protein ist im Gegensatz zum Peptid in der Lage, die DNABindung durch zusätzliche Wasserstoffbrückenbindungen und Salzbindungen zu stabilisieren. Trotzdem ist es möglich, die Bindung des PhoB-Proteins durch Kompetition mit dem Peptid PhoB(190-209) auf die Hälfte zu reduzieren [4]. Die Untersuchung der Punktmutanten zeigen auf Protein- und Peptid-Ebene eine gute Vergleichbarkeit. Die Daten der Einzelmolekülexperimente konnten durch die SPR-Untersuchungen bestätigt werden. Zum Beispiel konnte bewiesen werden, dass Arginin 203 sowohl auf Protein- als auch auf Peptidebene essentiell für die Bindung ist, da nach Austausch dieses Arginin-Restes gegen Alanin keine Bindung mehr beobachtet werden kann. Werden andere für die Bindung essentielle Aminosäuren ausgetauscht, wird sowohl die Bindung als auch die Lebensdauer des Komplexes stark reduziert. Zusammenfassend zeigt sich, dass die Einzelmolekülkraftspektroskopie in Kombination mit Ensemble-Messungen eine sehr gute Methode darstellt, um Interaktionen zwischen DNA und Proteinen zu untersuchen [1]. Insbesondere zeigte sich, dass Einzelmolekültechniken wie Kraftspektroskopie so empfindlich sind, dass sie biomolekulare Interaktionen nachweisen können, welche mit anderen Tech niken schwer oder gar nicht detektierbar sind. Es ist zu erwarten, dass diese erfolgreich etablierten Methoden das Verständnis der molekularen Erkennung noch weiter vertiefen werden. Förderung Diese Forschungsvorhaben werden von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des Sonderforschungsbereich „Physik von Einzelmolekülprozessen und molekularer Erkennung in organischen Systemen“, SFB 613 an der Universität Bielefeld gefördert. Foto: © Prof. Dr. Norbert Sewald
Literatur: |
L&M 2 / 2009
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |