|
Forscher
>
Dr. Nariman Ansari
>
Mehr Durchblick in der dritten Dimension!
Mehr Durchblick in der dritten Dimension!Potenziale der lichtscheibenbasierenden Mikroskopie für die Lebendzellbeobachtung dreidimensionaler Proben
Um das Leben zu verstehen, ist es erforderlich, Daten zu erfassen, die sich Es war einmal …
Die Untersuchung dynamischer Prozesse im lebenden Organismus erfährt seit Jahren ein stetig wachsendes Interesse in der biomedizinischen Forschung. Neue methodische und technologische Entwicklungen leisten einen großen Beitrag in der zeitaufgelösten und räumlichen Untersuchung sowohl molekularer als auch zellulärer Prozesse im lebenden Zellverband. Das Resultat dieser Entwicklung ist die Darstellung hochaufgelöster Strukturen im Organismus, ohne eine mechanische Manipulation durchzuführen. Der Einsatz von Fluoreszenzmarkern wie GFP (grün fluoreszierendes Protein) hat die Markierung und Verfolgung von Zielstrukturen in vitro und in vivo ganz wesentlich geprägt. In diesem Zusammenhang bilden Mikroskopieverfahren, die optische Schnitte von dreidimensionalen biologischen Proben generieren, eine Schlüsseltechnologie. Ein neuer Trend ist die Abwendung von einer „statischen“ Mikroskopie fixierter und gefärbter Organismen und die Hinwendung zur Echtzeitbeobachtung subzellulärer Strukturen im lebenden Organismus. Unterstützt wird diese Entwicklung durch die rasanten Fortschritte in der Computer- und Netzwerktechnologie. Ohne sie wären die hohe Aufnahmegeschwindigkeit, die extreme Speicherkapazität und die leistungsfähige Bildanalyse großer dreidimensionaler Datensätze nicht möglich. Epifluoreszenzmikroskope belasten biologische Proben
Konventionelle und konfokale Fluoreszenzmikroskope verwenden einen
Abb.1 Ein Lichtscheiben-Fluoreszenzmikroskop (LSM) des AK Stelzer. (A–C) verschiedene Perspektiven. (C) Aufnahmekammer. (D) Lebendaufnahme eines transgenen rotbraunen Reismehlkäfer-Embryos (Tribolium castaneum) im LSM aus vier verschiedenen Winkeln. Der Käfer hat die Aufnahmedauer von 50 Stunden ohne sichtbare Schäden überlebt und Nachkommen erzeugt [8].
der Probe und damit für die Anregung der Fluorophore sowie für die Detektion der Fluoreszenzemission verwendet. Dieses Prinzip wird auch als „Epifluoreszenzmikroskopie“ bezeichnet. Das Anregungslicht fällt durch die gesamte Probe und regt Fluorophore sowohl in der Fokalebene des Beleuchtungsobjektivs als auch ober- und unterhalb an. Die Energieerhaltung führt dazu, dass in jeder beliebigen Ebene die gleiche Zahl an Fluorophoren angeregt ist. Nimmt man einen Bildstapel auf, versucht also die dreidimensionale Fluorophorverteilung zu bestimmen, dann regt man mit jedem Bild, das man entlang der optischen Achse des Objektivs aufnimmt, immer alle Fluorophore an, die sich im Volumen des Bildstapels befinden. Benötigt man zum Beispiel 100 Aufnahmen, um einen dreidimensionalen Datensatz aufzuzeichnen, dann wurden die Fluorophore in der Mitte (also in der fünfzigsten Ebene) bereits 49-mal angeregt, bis sie im Fokus liegen. Konkret heißt das, dass man Zellkulturen etwa 10- bis 20- und Käferembryonen 200- bis 300-mal häufiger anregt, als man für eine Untersuchung eigentlich benötigt. Man kann also davon ausgehen, dass 10- bis 20- bzw. 200- bis 300-mal mehr Fluorophore zerstört werden, als zur Beobachtung beitragen und entsprechend mehr vom Organismus benötigte endogene organische Moleküle zerstört werden. Was leisten jüngste Entwicklungen in der Mikroskopie? Eine wichtige Frage ist daher, wie stark die derzeit verfügbaren Mikroskope eine biologische Probe belasten. Konventionelle Fluoreszenzmikroskope beleuchten die gesamte Probe mit mehreren 10 mW, während konfokale Fluoreszenzmikroskope meistens einen Strahl benötigen, der mehrere mW an Laserleistung verwendet. Zweiphotonen-Fluoreszenzmikroskope und 4Pi-Konfokalmikroskope bestrahlen eine
Abb.2 Das Prinzip der Lichtscheiben-Fluoreszenzmikroskopie. (A) Eine biologische Probe befindet sich innerhalb eines Zylinders (Philippe Girard). Sie wird seitlich mit einer Lichtscheibe (hier von links kommend) bestrahlt. Das Fluoreszenzlicht wird in einem Winkel von 90° detektiert (hier rechts liegend). Schematische Darstellung einer Probenbestrahlung durch eine statische Lichtscheibe (B) und eine dynamische Lichtscheibe (C).
Probe mit einem mehrere 10 mW starken Laserstrahl, während nichtlineare Verfahren in der Super-Resolution-Mikroskopie wie PALM/ STORM oder Stimulated-Emission-Depletion- Mikroskopie (STED) wahrscheinlich noch einmal einen Faktor zehn oder hundert höher liegen [1]. Alle Verfahren belasten immer die gesamte Probe und arbeiten mit extrem hohen Leistungen. Dazu kommt, dass Verfahren wie 4Pi, SIM und STED ganz wesentlich auf die Erhaltung einer Phasenbeziehung im Beleuchtungsprozess angewiesen sind. Selbst ein relativ dünnes Objekt wie eine lebende Zelle, das auf Deckgläsern wächst, ist bereits heterogen bezüglich seiner Brechungsindexverteilung. Daher muss man feststellen, dass alle derzeit verfügbaren hochauflösenden Verfahren für die modernen Lebenswissenschaften mit großer Vorsicht und Sorgfalt zu verwenden sind. Lösung Die derzeit beste Lösung für die Lebendzellbeobachtung dreidimensionaler Proben ist die lichtscheibenbasierte Mikroskopie. Lichtpunkte und Lichtscheiben sind zwar seit über hundert Jahren bekannte Konzepte, aber nur mit Lasern lassen sich diffraktionslimitierte Punktbeleuchtungen (z.B. konfokale Fluoreszenzmikroskopie) und diffraktionslimitierte Lichtscheibenbzw. Lichtblattbeleuchtungen realisieren und für die Bilderzeugung nutzen. Das Potenzial wurde erst Anfang der 2000er-Jahre durch die Arbeitsgruppe von Ernst Stelzer am EMBL in Heidelberg erkannt. Technologische Fortschritte in der Kameratechnologie, der Datenverarbeitung und vor allem in der Lebendmarkierung (z. B. GFP) führen dazu, dass die Lichtscheiben-Fluoreszenzmikroskopie (Abb. 1) in der dreidimensionalen Fluoreszenzaufnahme immer häufiger eingesetzt werden kann [2, 7]. LSFM ermöglicht nicht nur ein tieferes Eindringen in biologische Proben, sondern vor allem eine tiefere Einsicht in zelluläre und molekulare Prozesse in einer sich dreidimensional entwickelnden Probe. Die Interaktion von Zellen mit ihrem Mikromilieu gewinnt in der aktuellen Forschungslandschaft immer mehr an Bedeutung und auch bei hochaktuellen Themen, wie der Stammzellforschung, dem Tissue Engineering und der Systembiologie rechnet man LSFM zu den Schlüsseltechnologien. Das Prinzip der Lichtscheibe Um der Dauerbestrahlung durch konventionelle Epifluoreszenzmikroskope zu entgehen, erfolgen in den verschiedenen Implementierungen der LSFM die Probenanregung und Probendetektion über zwei separate optische Lichtpfade, die rechtwinklig zueinander angeordnet sind (Abb.2 A). Die Lichtscheibe wird flächig über einezylindrische Linse (hier spricht man von einer statischen Lichtscheibe - Single Plane Illumination Microscope, SPIM) oder zeilenweise über einen Scan-Spiegel (hier spricht man von einer dynamischen Lichtscheibe – Digital Scanned Light sheet-based Microscope, DSLM) generiert (Abb. 2 B u. C) und über ein Anregungsobjektiv auf die Fokusebene des Detektionsobjektivs gelegt [2, 3]. Die Fokalebene des Detektionssystems überlappt mit dem Zentrum der Beleuchtungslichtscheibe. Daraus ergibt sich, dass im Wesentlichen nur der Teil der Probe beleuchtet wird, der auch beobachtet wird. Minimale Bleichung, maximale Effizienz
Durch die selektive Anregung der LSFM werden kaum Fluorophore außerhalb der Fokusebene angeregt. Dieser Vorgang wird als „optische Sektionierung“ bezeichnet. Er hat zur Folge, dass ein Ausbleichen von Fluorophoren sowie phototoxischeEffekte in der Probe um den Faktor zehn bis mehrere hundert verringert werden. Eine neue Form der Probenpräparation Gewöhnlich wird mit LSFM die Probe ebenenweise durch die Lichtscheibe (entlang der Z-Achse) bewegt und als Bildstapel aufgenommen. Aus den Stapeln zweidimensionaler Bilder wird jeweils ein dreidimensionales Bild rekonstruiert. Die Architektur der LSFM erlaubt es, Proben unter dreidimensionalen Bedingungen in einer Perfusionskammer zu kultivieren und zu manipulieren. Abhängig von der biologischen Fragestellung ergeben sich für die Präparation verschiedene Ansätze. Klassisch wird die Probe in einen transparenten, gasdurchlässigen Gelbildner (z. B. Agarose) überführt und in eine Glaskapillare aufgezogen. Nach dem Aushärten des Gels wird die Probe auf einen geeigneten Probenhalter in die Perfusionskammer des Lichtscheibenmikroskops gesteckt (Abb. 2 A). Ein dünner Stift an der Oberseite der Probenhalterung drückt den Teil des Gels, in den die Probe eingebettet ist, aus der Glaskapillare heraus. Die Probe kann nun in der Perfusionskammer und im geeigneten Wachstumsmedium über mehrere Tage in Echtzeit beobachtet werden (Abb. 1 D). Außer entlang der X-, Y- und Z-Achsen kann die Probe in der LSFM über die vertikale Achse frei rotiert werden. Dadurch ist die Aufnahme aus verschiedenen Richtungen möglich. Verbesserte räumliche Auflösung Durch geeignete dreidimensionale Bildbearbeitungsprogramme können die komplementären Bildstapel aus verschiedenen Richtungen und Bildebenen kombiniert werden (Abb. 3). Das hieraus resultierende dreidimensionale Gesamtbild fasst die Details aus allen Perspektiven
Abb.3 Exemplarische Darstellung einer automatisierten, dreidimensionalen Bildanalyse. (A) zeigt eine LSM-Aufnahme von fluoreszenzgefärbten Zellkernen (grau) in einem dreidimensionalen Brustkrebs-Sphäroiden. Es wurden keine aufwendigen, histologischen Schnitte angefertigt. Das Bild zeigt die mittlere Ebene eines 200 Bildstapel großen Datensatz. Mit einer dreidimensionalen Segmentierung (B–D) können verschiedene Merkmale quantifiziert werden. Z.B. können das Volumen (E) und die Rundheit (F) der Zellkerne in der Probe effizient erfasst und untersucht werden (Alexander Schmitz).
und Ebenen zusammen und erzeugt daraus eine exakte räumliche und vor allem annähernd isotrope Auflösung. Diese Funktion überwindet die niedrige axiale Auflösung anderer Mikroskope und prädestiniert LSFM für die Aufnahme millimetergroßer Proben. Die Lizenzierung dieser Technologie an Carl Zeiss, führte 2013 zur Kommerzialisierung der LSFM (Zeiss Lightsheet Z.1 Mikroskop) und dem Zugang eines breiteren Publikums zu dieser Technologie [4]. Mehr Durchblick im lebenden Organismus Zusammengefasst machen die niedrige Probenbelastung und die hohe axiale Auflösung LSFM ideal für die Lebendbeobachtung von Pflanzen [5], dreidimensionalen Zellkulturen [6] und ganzer Embryonen und Gewebe [7, 8]. Die Technologie erlaubt es erstmals auch, vergleichsweise große, aus vielen Zellen bestehende, Organismen unter natürlichen Bedingungen zu beobachten. Schließlich wachsen Zellen normalerweise nicht auf flachen und harten Oberflächen, sprich auf Deckgläsern oder in Petrischalen, sondern in einem Verbund mit vielen anderen Zellen. Zellen sind in diesem Verband auch nicht isoliert. Sie beeinflussen ihre Umgebung und werden im gleichen Maße durch ihre Umgebung beeinflusst.
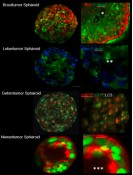
Abb.4 Dreidimensionale Zellkulturen eignen sich hervorragend für die Lichtscheiben-Fluoreszenzmikroskopie. In dieser Abbildung sind verschiedene Tumorsphäroid-Modelle dargestellt, die über verschiedene fluoreszierende Farbstoffe oder Fusionsproteine markiert wurden. Durch die Markierung können molekulare Vorgänge in Echtzeit- oder in Endzeitmessungen visualisiert und quantifiziert werden. Auch können gewebstypische Strukturen in den dreidimensionalen Zellkulturen am LSFM mit sehr geringem Aufwand nachgewiesen werden. * = Brustdrüsenkanal. **= Gallenflüssigkeitskanal, ***=Zyste.
Zellen müssen demnach zwingend in einem physiologisch relevanten Kontext kultiviert und untersucht werden, der entweder in Gewebestücken, kleinen Modellembryonen oder dreidimensionalen Zellkulturen zu finden ist. Solche Kontexte sind letztendlich auch notwendig, um Europäische Programme wie REACH mit ethisch verträglichen Alternativen zu Tiermodellen durchführen zu können. Die auf diese Art kultivierten Zellen oder Organismen überleben die Beobachtung in einem Lichtscheibenmikroskop auch ohne erkennbare Schäden und haben trotz der Beobachtung im Mikroskop Nachkommen, die selbst fruchtbar sind. Perspektiven der LSFM
LSFM hat sich in den letzten Jahren zu einer der populärsten und wichtigsten Technologien in der dreidimensionalen Fluoreszenzmikroskopie und der dreidimensionalen Zellbiologie entwickelt. Das Innovationspotenzial ist noch immer sehr groß. Aktuell ist es Forschern möglich, dynamische Vorgänge in sehr kurzen Intervallen im lebenden Organismus über mehrere Stunden und Tage hoch aufgelöst in drei Dimensionen zu erfassen. Wir erwarten in Zukunft eine weitere Verbesserung des Auflösungsvermögens der LSFM durch dünnere Lichtscheiben, höhere Eindringtiefe in das Gewebe, schnellere und
-> nariman.ansari@physikalischebiologie.de
Literatur |
L&M 1 / 2016
Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |