|
Forscher
>
Tobias Krebs
>
Automatisiertes Expositionssystem für Zellkulturen an der Gas-Flüssigkeits-Grenzschicht
Automatisiertes Expositionssystem für Zellkulturen an der Gas-Flüssigkeits-GrenzschichtFeinstaub in der LungeDie gesundheitlichen Auswirkungen gasgetragener Nano- und Feinstpartikel werden kontrovers diskutiert. Um eine realitätsnahe Bewertung der Wirkung dieser Aerosole durch Bioassays mit menschlichen Lungenzellkulturen durchzuführen, wurde das voll automatisierte Vitrocell-Expositionssystem entwickelt: So können Aerosole reproduzierbar auf die Zellen aufgebracht werden, um anschließend die biologischen Wirkungen zu untersuchen. Neue Materialien – neue Chancen, neue Risiken? Mit der Entwicklung der Messmethoden zu immer höheren Auflösungen und mit dem dadurch zunehmenden Verständnis für den submikronen Bereich hat sich in den vergangenen zwei Jahrzehnten sowohl die Nutzung als auch die Risikobewertung von nanoskaligen Stoffen und Systemen stark verändert: Die Nanopartikel-technologie eröffnet neue Möglichkeiten im Bereich der Materialwissenschaften, führt aber in der großtechnischen Anwendung zu neuen Fragestellungen im Hinblick auf Arbeitsplatzsicherheit und Umweltschutz. Der Reiz von Nanopartikeln, also Partikeln, die gemäß der EU-Norm in mindestens einer Dimension kleiner als 100nm (=100×10-9m) sind, liegt darin, dass sich die Mehrzahl ihrer Atome nicht mehr im Molekülinneren, sondern an der Außenfläche befindet und sich dadurch die makroskopischen Eigenschaften verändern können. Die Nanopartikel können z.B. erhöhte Löslichkeit und chemische Reaktivität sowie reduzierte Schmelzpunkte aufweisen. Auch Superparamagnetismus und höhere Brechungsindizes und damit größenabhängige Farbigkeit wurden beobachtet. Neben den oft gewünschten „neuen“ physikalischen Eigenschaften können diese Partikel aber auch neue biologische Eigenschaften aufweisen, d.h., sie können in einem biologischen System bisher unbekannte oder für diesen Stoff „untypische“ biologische Antworten verursachen wie z.B. Entzündungen. Bisher als unbedenklich eingestufte Stoffe können also aufgrund ihrer geringen Größe als Nanopartikel zu einem potenziell schädlichen Produkt werden. Unerwünschte Nanopartikel Aber auch ungewollt entstandene Nanopartikel werden immer mehr zum Problem: Durch die Verbesserung von Verbrennungssystemen und Filtertechnik in Industrie und Verkehr ist die Luftbelastung seit den 80er-Jahren zwar stark gesunken, aber gleichzeitig trat der Feinstaub messbar in den Vordergrund: Der Schwellenwert für die Feinstaubbelastung von 50µg/m³, dessen Überschreitung an maximal 35 Tagen im Jahr erlaubt ist, wurde in Großstädten trotz der Einführung von Umweltzonen auch 2014 häufig überschritten. Dabei liegt dieser Wert noch deutlich über der Empfehlung der WHO. In epidemiologischen Studien kamen Dockery und Pope zu dem Ergebnis, dass die Luftverschmutzung mit Feinstäuben mit dem relativen Risiko von Erkrankungen und Todesfällen korreliert [1]. Im Rahmen mehrerer Studien konnten Wissenschaftler auch in Deutschland nachweisen, dass die Zahl der Atemwegs- und der Herz-Kreislauf-Erkrankungen mit der Konzentration an Feinstaub zunimmt [2]. Feinstpartikel können tief in den menschlichen Atemtrakt eindringen und dort über ein Jahr verweilen, bevor die Abreinigungsmechanismen der Lunge sie wieder aus dem Körper transportieren (Abb.1).
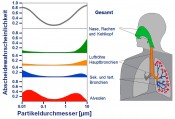
Abb.1 Abscheidegrade in Abhängigkeit der Partikelgröße für die verschiedenen Regionen des menschlichen Atemtrakts [9]
Je kleiner, desto tiefer Während Partikel zwischen 1 und 10µm Durchmesser vor allem im Nasen-Rachen-Raum (grüne Kurve) und in den oberen Bronchien (gelbe Kurve) abgeschieden werden, dringen Partikel unter 1µm Durchmesser bis in die sekundären und tertiären Bronchien (blaue Kurve) und die Alveolen (rote Kurve) vor, in denen sie dann eine mittlere Verweilzeit bis zum Abtransport durch die Reinigungsmechanismen der Lunge von ca. 400 Tagen haben. Der Alveolarraum, in dem der Gasaustausch von Luftsauerstoff in das Blut und Kohlendioxid in die Atemluft stattfindet, weist beim Erwachsenen eine mittlere Gasaustauschfläche von 140m² auf. Da in diesem Bereich praktisch kaum Luftbewegungen vorherrschen, wird das Gas- und Partikelverhalten hauptsächlich durch Diffusionsprozesse charakterisiert. Wie Nanopartikel untersucht werden Die Zusammenhänge zwischen den Partikelemissionen, ihrer Verweilzeit im menschlichen Körper und ihrer biologischen Wirkungen sind daher Gegenstand intensiver Untersuchungen. Dabei werden neben epidemiologischen Studien Tierversuche durchgeführt, um systemische Effekte wie die Herz-Kreislauf-Erkrankungen untersuchen zu können. Zunehmend werden Screening-Untersuchungen und Methodenentwicklungen auf Zellkulturbasis durchgeführt. Bei diesen Studien „im Glas“ (lateinisch: in vitro) werden die Zellkulturen den zu untersuchenden Partikeln ausgesetzt und nach einer definierten Inkubationszeit auf biologische Reaktionen untersucht. Diese Antworten können in sehr frühem Stadium nachgewiesen werden, z.B. Veränderungen der metabolischen Vorgänge in Zellen oder können erst nach einiger Zeit auftreten wie z.B. die Ausschüttung von Zytokinen (Botenstoffe), die als Marker für entzündliche Prozesse bekannt sind. Das ALI-Verfahren Bei toxikologischen Standardverfahren werden die Partikel im Nährmedium, das zur Kultivierung der Zellen benötigt wird, suspendiert und auf die Kulturen gegeben. Für die Untersuchung von Zellen, die aus Organen ohne Luftzutritt den Partikeln ausgesetzt werden können wie z.B. Darmzellen, ist diese Methode gut geeignet. Für die Inhalationstoxikologie gasgetragener Partikel aber ist diese sogenannte „submers“-Methode (submers=unter einer Flüssigkeit) weniger geeignet. Zum einen ist die vollständige Bedeckung von Lungenzellen mit Flüssigkeit unphysiologisch, weil die Zellen in der Lunge nur mit einem dünnen Flüssigkeitsfilm bedeckt sind. Zum anderen werden die Partikel sowohl bei der Probenahme als auch bei der Applikation auf die Zellen durch das Kulturmedium stark beeinflusst, was die biologische Wirksamkeit deutlich verändern kann. Da die Partikel in der Flüssigkeit als Kolloid vorliegen bzw. teilweise agglomerieren, kann die auf den Zellen deponierte Dosis nicht exakt bestimmt werden. Daher wird seit einigen Jahren eine andere Technik verwendet, in der die Zellen an ihrer Gas-Flüssigkeits-Grenzschicht, d.h. die Zellen sind nur mit einem dünnen Flüssigkeitsfilm bedeckt, exponiert werden. Diese sogenannte ALI-Exposition (ALI=Air-Liquid-Interface) ist realitätsnäher und besser reproduzierbar. Insbesondere sind hier die Dosisverhältnisse besser definiert [3, 4].
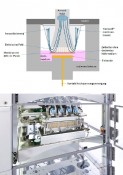
Das bedienerfreundliche, automatisierte Expositionssystem
Abb.2 Automatisiertes Expositionssystem zur reproduzierbaren Exposition von Bioassays an der Gas-Flüssigkeits-Grenzschicht. Links: Schematische Darstellung der verfahrenstechnischen Hauptkomponenten. Rechts: Foto des fertigen Produktes von Vitrocell Systems Quelle: KIT, Vitrocell Systems GmbH
Zunächst wird aus dem jeweiligen Prozess eine Probe des zu untersuchenden Aerosols mit einem Volumenstrom von 1?m³/h entnommen und im ersten Schritt durch einen PM2,5-Low-Volume-Impaktor geleitet. Ziel der Vorabscheidung größerer Partikel ist, die Deposition in den oberen Atemwegen zu simulieren und zu vermeiden, dass einzelne große Partikel einen nicht reproduzierbaren Beitrag zur deponierten Masse verursachen und so die Analyse mit dem Bioassay beeinträchtigen. Danach wird durch Wasserdampfdosierung die relative Feuchte auf einen Wert von 85?%?r.H. eingestellt, um die Zellkulturen vor dem Austrocknen zu schützen. Das befeuchtete Aerosol strömt zur Stabilisierung in einen Partikelreaktor. Auf drei Ebenen befinden sich jeweils Probenahmesonden zur isokinetischen Probennahme, von denen das konditionierte Aerosol anschließend in die einzelnen Expositionskammern der Vitrocell-Module geleitet wird. Zusätzliche Probennahmepunkte stehen für eine externe Partikelmesstechnik wie z.B. Mobilitätsanalysatoren oder eine Filterprobenahme für Elektronenmikroskopieproben zur Verfügung. Die Vitrocell Module sind das Herzstück des Systems: In ihnen werden die apikal auf Membraneinsätzen kultivierten Zellkulturen mit dem Aerosol beaufschlagt, während sie basal mit Nährmedium versorgt werden (Abb.3). Alle Komponenten werden gleichmäßig auf 37°C temperiert. Zur Steigerung der Depositionseffizienz besteht die Möglichkeit, durch eine Elektrode unterhalb des Nährmediums eine Hochspannung anzulegen. Durch das so zwischen Aerosolinlet und Zellkultur erzeugte elektrische Feld werden geladene Partikel durch die elektrischen Kräfte verstärkt auf der Zellkultur deponiert.
Abb.3 Expositionskammer mit Transwellkulturschale. Oben: Schematische Darstellung mit Elektrode unter dem Nährmedium und den Strömungslinien des Aerosolflusses über die Zellkultur. Unten: Foto eines 4er-Vitrocell-Moduls für drei 6-well-Inserts und eine Schwingquarzmikrowaage in der Schublade des Expositionssystems Quelle: KIT, Vitrocell Systems GmbH
Alle Flüsse werden durch integrierte Mass-Flow-Controller gesteuert. Die Bedienung des Gerätes erfolgt über einen Touch-Screen-Monitor. Die intuitive HMI (human-machine interface) Oberfläche für alle Steuerungs- sowie Datenerfassungsfunktionen wurde eigens für das Gerät entwickelt. Es besteht die Möglichkeit, das System in ein Netzwerk einzubinden. Die Anlage ist bereits in zwei EU-Projekten (NanoMILE und QualityNano) sowie in dem virtuellen Institut der Helmholtz-Gemeinschaft (HICE) im Einsatz. Hierbei wurden bereits umfangreiche Erfahrungen mit Nano-Aerosolen gewonnen.
Tab.1 Übersicht über erfolgreich eingesetzte und untersuchte Aerosole, Zellkulturen und biologische Effekte
Fazit Die bisherigen Erfahrungen mit dem automatisierten Expositionssystem zeigen, dass die Wirkungen von Nanopartikeln auf menschliche Lungenzellen reproduzierbar analysiert werden. Zahlreiche Gruppen aus europäischen Laboren haben Erfahrungen mit der neuen Technologie gesammelt. Da mit dem neuen System nun realitätsnahe Expositionen möglich sind, wird erwartet, dass erstmals eine valide Datenbasis zur Bewertung der von Feinstaubemissionen und Nanomaterialien durch In-vitro-Experimente geschaffen wird und die Anzahl von Tierversuchen in diesem Bereich reduziert werden kann.
Literatur Bild: © istockphoto.com| CDH_Design |
L&M 2 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |