|
Forscher
>
Lars Büter
>
Kopplung von Elektrochemie (EC) und Massenspektrometrie (MS) für die Metabolismusforschung
Kopplung von Elektrochemie (EC) und Massenspektrometrie (MS) für die MetabolismusforschungAlternativen zum Tierversuch?Die Aufklärung des Metabolismus potenzieller neuer Wirkstoffe ist eine der großen Herausforderungen in der pharmazeutischen Forschung und Entwicklung. Sie ist in der Regel sehr zeitaufwändig und kostenintensiv. Klassische Ansätze basieren dabei im Wesentlichen auf In-vivo-Experimenten mit Labortieren ebenso wie auf In-vitro-Untersuchungen mittels Leberzellen oder daraus gewonnenen Leberzellmikrosomen. Im Gegensatz zu diesen etablierten Verfahren wird im Folgenden eine Methode präsentiert, die auf einem vollständig instrumentellen Ansatz beruht. Hierbei wird in einer elektrochemischen Zelle der oxidative Metabolismus eines Wirkstoffes simuliert, und die erzeugten Produkte werden online in ein Massenspektrometer transferiert, mit dessen Hilfe die Identifizierung erfolgen kann. Hintergrund Im menschlichen Körper besteht einer der Hauptwege des Abbaus und der Eliminierung von Xenobiotika wie z.B. pharmazeutischen Wirkstoffen, Nahrungsmittelzusätzen oder Kosmetikinhaltsstoffen in einem anfänglichen enzymatischen Oxidationsschritt (Phase-I-Metabolismus: Funktionalisierung). Dieser wird durch Enzyme der Cytochrom-P450-Superfamilie (CYP) katalysiert. In einem zweiten Schritt folgt dann in der Regel eine Bindung der gebildeten – oftmals sehr reaktiven – Produkte an endogene nukleophile Abfangreagenzien wie z.B. an das Tripeptid Glutathion oder an Proteine (Phase-II-Metabolismus: Konjugation). Dieser Metabolismusschritt wird vor allem durch Transferasen katalysiert. Das Endziel dieser körpereigenen Reaktionskaskade ist schließlich die Ausscheidung der Xenobiotika, die zumeist über die Nieren erfolgt. Heute basieren etablierte Methoden zur In-vitro-Simulation des oxidativen Phase-I-Metabolismus, um den es in diesem Artikel zuvorderst gehen soll, auf dem Einsatz von CYP-Enzymen der Leber. Diese werden entweder in Form einer perfundierten Tierleber, von Leberschnitten, von Leberzellen oder – dies ist am gebräuchlichsten – von Leberzellmikrosomen eingesetzt. Obschon diese Methoden die In-vivo-Bedingungen in guter Näherung abzubilden vermögen, sind doch die Nachteile hierbei, dass sie allesamt auf Tierversuchen basieren sowie mühsam und zeitaufwändig sind. Nachteilig ist zudem, dass viele Metabolite sehr reaktiv sind, und nicht in ihrer freien Form sondern nur als Konjugate mit Bestandteilen z.B. des Mikrosomenansatzes detektiert werden kommen. Hinzu kommt, dass die Reproduzierbarkeit wie bei vielen biologischen Systemen nur eingeschränkt gegeben ist. Vielen Synthesechemikern ist die Elektrochemie (EC) als etablierte Methode zur Durchführung von Oxidationsreaktionen ein Begriff. Es bietet sich daher an, die EC ebenfalls zur Simulation des oxidativen Phase-I-Metabolismus von Xenobiotika zu nutzen. Hierfür haben sich in den letzten Jahren insbesondere die folgenden beiden Ansätze etabliert: Zum einen kann eine elektrochemische Durchflusszelle direkt an ein Massenspektrometer gekoppelt werden (EC-MS) [1,2], zum anderen kann zwischen die elektrochemische Zelle und das Massenspektrometer noch eine flüssigchromatografische (LC) Trennung geschaltet werden (EC-LC-MS; Abb. 1) [3,4]. In der Durchflusszelle werden die Ausgangssubstanzen bei einem konstanten Potenzial, das zuvor experimentell ermittelt wurde (siehe unten), oxidiert. Anschließend erfolgt entweder direkt oder nach Trennung die Detektion der Oxidationsprodukte im Massenspektrometer. Mit den vielfältigen Experimenten und technischen Möglichkeiten der modernen Massenspektrometrie, z.B. Tandem-MS, Bestimmung der exakten Masse usw., kann die Identifizierung der Produkte erfolgen. Während die direkte Kopplung von EC und MS insbesondere dann von Interesse ist, wenn sehr reaktive Metabolite, die z.B. in Mikrosomenansätzen mit ihren komplexen Matrices sofort weitereagieren würden, ohne signifikante Zeitverzögerung detektiert werden sollen, bietet sich die EC-LC-MS-Kopplung dann an, wenn komplexe Mischungen in der Durchflusszelle oxidiert werden. Somit wird – eine ideale LC-Trennung vorausgesetzt – zu einem gegebenen Zeitpunkt jeweils nur das Reaktionsprodukt einer Einzelsubstanz detektiert. Zudem erlaubt die chromatografische Trennung – zumeist handelt es sich hierbei um Umkehrphasen (RP)-Trennungen – anhand der Elutionsreihenfolge Aussagen über die Polarität einzelner Produkte zu treffen und somit die Identifizierung zu erleichtern.
Abb.1 Der Aufbau der Kopplung von elektrochemischer Durchflusszelle, flüssigchromatografischer Trennung und Massenspektrometrie (EC-LC-MS). Im Falle der reinen Kopplung von EC und MS ist der Auslass der EC-Zelle direkt mit dem Ionisationsinterface des Massenspektrometers verbunden.
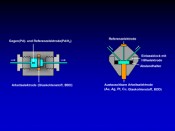
Abb.2 Aufbau einer coulometrischen Durchflusszelle (links) und einer amperometrischen Zelle (rechts). Beide Zelltypen bestehen aus einer Dreielektrodenanordnung. Das Potenzial wird zwischen Gegen- und Arbeitselektrode angelegt. Polarisationseffekte an der Gegenelektrode, die zu einem instabilen Arbeitspotenzial führen würden, werden durch die Verwendung einer Referenzelektrode, zumeist Palladium/Wasserstoff (Pd/H2), kompensiert.
Die elektrochemische Zelle Heute werden die meisten Experimente zur elektrochemischen Simulation oxidativer Metabolismusvorgänge mit coulometrischen Durchflusszellen oder amperometrischen Dünnschichtzellen durchgeführt (Abb. 2). Beide Zelltypen bestehen aus einer Dreielektrodenanordnung aus Arbeits-, Referenz- und Gegenelektrode. Die gegenwärtig verwendete Arbeitselektrode der coulometrischen Zellen besteht typischerweise aus einer porösen Glaskohlenstoffelektrode oder Bor-dotiertem Diamant (BDD). Die amperometrische Dünnschichtzelle wird auch mit anderen Materialien für die Arbeitselektrode wie z.B. Au, Ag, Pt, Cu eingesetzt. In Abhängigkeit vom Elektrodenmaterial können dabei unterschiedliche Oxidationsprodukte erzielt werden, was u.?a. auf Überspannungseffekte und die unterschiedliche chemische Reaktivität der Elektrodenmaterialien in verschiedenen Puffersystemen zurückzuführen ist. Die Bedingungen der elektrochemischen Oxidation müssen für jeden Zelltyp und jede Applikation hinsichtlich des Oxidationspotenzials, des verwendeten Puffers und der Flussrate optimiert werden. Für die meisten Anwendungen wird ein physiologischer pH-Wert von 7,4 eingestellt. Für die Optimierung des Oxidationspotenzials ist es am einfachsten, ein so genanntes Massenvoltammogramm aufzunehmen. Hierbei wird der Auslass der EC-Zelle direkt mit dem Ionisationsinterface des Massenspektrometers verbunden. Die zu untersuchende Substanz wird dann kontinuierlich durch die Zelle gepumpt, wobei an diese eine Potenzialrampe angelegt wird und das Massenspektrometer zeichnet fortlaufend Spektren auf. Die dreidimensionale Auftragung der Massenspektren gegen das angelegte Potenzial (Massenvoltammogramm, Abb. 3) erlaubt dann Aussagen über das Potenzial, bei dem unter den gegebenen Bedingungen wie Flussrate und Pufferzusammensetzung die meisten Oxidationsprodukte zu erwarten sind.
Abb.3 Massenvoltammogramm von Anilin, das sensibilisierend auf die Haut wirkt und aus Azofarbstoffen in Kosmetika freigesetzt werden kann. Die Intensität des MS-Signals ist aufgetragen gegen das Masse-zu-Ladungsverhältnis (m/z, auf der x-Achse) und die angelegte Potenzialrampe (in mV, auf der z-Achse). Man erkennt, dass in diesem Fall bei steigendem Potenzial Oligomere des Anilins gebildet werden [6].
Validierung und Anwendungen
Zahlreiche Untersuchungen haben gezeigt, dass CYP450-katalysierte Oxidationsreaktionen und die elektrochemische Simulation dieser Reaktionen – obschon auf unterschiedlichen Mechanismen beruhend – in weiten Teilen eine gute Übereinstimmung zeigen. Hierfür wurde eine Vielzahl von Wirkstoffen wie das Muskelrelaxans Tetrazepam, das Schmerzmittel Paracetamol, das Neuroleptikum Clozapin oder der Betablocker Metoprolol, um nur einige Beispiele zu nennen, jeweils mittels EC und isolierten Human- bzw. Rattenlebermikrosomen untersucht. Mit Ausnahme von Expoxidierungen sowie der Alkohol/Aldehyd-Oxidation konnten beim Vergleich zwischen EC und Mikrosomen die folgenden Reaktionen erfolgreich elektrochemisch simuliert werden:
Literatur Foto: ©istockphoto.com| ma-k, ©panthermedia.net| Emilia Stasiak |
L&M 6 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |