|
L&M-2-2012
>
Katalysator 3.0
Katalysator 3.0Wie kleinste Partikel die Welt verändernKatalysatoren spielen längst für alle Bereiche des täglichen Lebens eine entscheidende Rolle. Sei es im Autokatalysator zur Abgasbehandlung, zur Produktion von Düngemitteln, um eine ausreichende Lebensmittelproduktion sicherzustellen oder in der gesamten chemischen Industrie, um Produkte des täglichen Bedarfs wie Kunststoffe oder auch Treibstoffe effizient herzustellen. Dennoch ist oft nicht klar, was es eigentlich mit Katalysatoren auf sich hat. Katalyse – wer braucht sie? Katalysatoren gewinnen zunehmend an Bedeutung, besonders angesichts der gesellschaftlichen Herausforderungen unserer Zeit wie begrenzten Reserven fossiler Rohstoffe (Erdöl, Erdgas und Kohle), der zunehmenden Emission von Treibhausgasen und dem damit einhergehenden Klimawandel sowie dem Ausstieg aus der Kernenergie und den damit verbundenen Herausforderungen der Energieerzeugung und -speicherung. Für all diese Bereiche stellen Katalysatoren eine Schlüsseltechnologie dar und sind untrennbar mit der Entwicklung einer nachhaltigen Wertschöpfung der Zukunft verknüpft [1]. Vor der nächsten Lobesrede aber zunächst zu der Frage, was es mit einem Katalysator denn nun genau auf sich hat. Die reine Definition eines Katalysators besagt dabei Folgendes: „Ein Katalysator erhöht die Reaktionsgeschwindigkeit einer chemischen Reaktion, ohne dabei selbst verbraucht zu werden. Er senkt also die Aktivierungsenergie und ändert damit die Kinetik der Reaktion, nicht jedoch die Thermodynamik und damit die Lage des chemischen Gleichgewichts.“ Fasst man diese Definition in eine etwas bildlichere Darstellung, so wird klar, dass ein Katalysator dafür sorgt, dass eine bestimmte Umwandlung über einen anderen Weg verläuft und dadurch weniger Energie benötigt. Die Moleküle müssen im übertragenen Sinn also nicht den Berggipfel überwinden, um in das nächste Tal zu gelangen, sondern können mit dem Katalysator als Bergführer auch einen deutlich leichteren Weg nehmen, um das Ziel zu erreichen . Der Katalysator geht dabei im Verlauf der Reaktion mit den Reaktionspartnern eine Verbindung ein, die sich nach erfolgreicher Umsetzung wieder löst. Vielleicht steht daher auch das chinesische Ideogramm für Katalysator – „tsoo mei“ – für Heiratsvermittler. Denn auch bei der Katalyse müssen zunächst alte Bande aufgebrochen und anschließend neue geknüpft werden, bevor der Heiratsvermittler sich aus der neu geschaffenen Verbindung zurückzieht. Ein Katalysator sorgt somit dafür, dass für eine Reaktion weniger Energie benötigt wird. Dadurch kann die Reaktion beispielsweise schon bei deutlich geringeren Temperaturen ermöglicht werden und ausreichend schnell ablaufen, sodass der gesamte Prozess energiesparender wird. Vielleicht sind für eine Umwandlung so nicht mehr einige hundert Grad Celsius notwendig, sondern die Ausgangsstoffe können schon bei Raumtemperatur oder nur wenig darüber effizient umgesetzt werden. Zusätzlich bieten Katalysatoren die Möglichkeit, die Selektivität einer Reaktion zu erhöhen. Werden in einer Reaktion mehrere Produkte gebildet, ist es mit einem geeigneten Katalysator möglich, einen Reaktionsweg zu bevorzugen und damit nur ein Produkt gezielt herzustellen. Katalyse im 21. Jahrhundert
Katalysatoren haben ihre Anwendungsbereiche im Umweltschutz, z.B. als Autoabgaskatalysator oder für die Reinigung von Abgasen von Produktionsprozessen jeder Art, aber darüber hinaus sind sie auch für die Produktion von Basischemikalien der chemischen Industrie, Treibstoffe, Polymere, aber auch alle weiteren Produkte inkl. Pflanzenschutzmittel oder pharmazeutische Produkte unerlässlich. Betrachtet man die Spannweite der Einsatzgebiete, wird schnell klar, dass Katalysatoren in fast allen Bereichen des täglichen Lebens eine wesentliche Rolle spielen. Sei es zur Produktion des Kunststoffs für die Wasserflasche oder um Düngemittel herzustellen, um eine ausreichende Nahrungsmittelversorgung sicherzustellen.
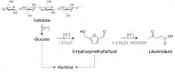
Nachwachsende Rohstoffe effizient nutzen Die Katalysatoren der Zukunft müssen sich daher im Kontrast zu den letzten hundert Jahren neuartigen Herausforderungen stellen. Um Treibstoffe herzustellen, werden heute zum Beispiel Prozesse benötigt, die bei hohen Temperaturen und Drücken in der Gasphase ablaufen. Setzt man aber nachwachsende Rohstoffe für die Produktion von Treibstoffen und Chemikalien ein, muss der Katalysator stattdessen in einem flüssigen Medium bei niedrigeren Temperaturen und nur mäßigem Druck effizient arbeiten. Zusätzlich gilt es nicht mehr, unpolare Moleküle zu funktionalisieren, sondern vielmehr nachwachsende Rohstoffe mit hohem Sauerstoffgehalt und dementsprechend hohem Funktionalisierungsgrad effizient zu defunktionalisieren. Das Einsatzspektrum und die angestrebten Reaktionen verändern sich also deutlich. Doch auch diesen Herausforderungen ist die Katalyse gewachsen. In aktuellen Untersuchungen konnte Holz direkt in Wasser als Lösungsmittel an festen Katalysatoren in mögliche Basischemikalien einer zukünftigen Bioraffinerie umgesetzt werden [2]. Der wesentliche Bestandteil des Holzes, bei dem es sich aus chemischer Sicht im Wesentlichen um Lignocellulose handelt, ist dabei die Cellulose. Cellulose selbst ist ein Polymer aus Glucosemolekülen, die über -1,4- glykosidische Bindungen miteinander verknüpft sind. Ziel muss demnach eine Hydrolyse der Cellulose zu Glucose sein. Enzymatisch gelingt dieser Schritt derzeit zwar bereits sehr selektiv, allerdings erschwert die stabile Verknüpfung von Lignin, Hemicellulose und Cellulose einen effizienten Aufschluss in die Einzelkomponenten, sodass derzeit nur geringe Raum-Zeit-Ausbeuten erreicht werden. Zusätzlich weist Cellulose teilkristalline Bereiche auf, ist nicht in konventionellen Lösungsmitteln löslich und zeichnet sich durch intra- und intermolekulare Wasserstoffbrückenbindungen aus. All diese Eigenschaften machen Cellulose zu einem mechanisch und auch chemisch sehr widerstandsfähigen Material. Die wesentliche Herausforderung für die Entwicklung geeigneter fester Katalysatoren und Reaktionssysteme, um Cellulose beziehungsweise Holz in viel versprechende Basischemikalien umzusetzen, beruht dementsprechend auf der hohen Stabilität der Cellulose. Daneben stellt die Selektivität zu ausgewählten Zielmolekülen eine zusätzliche Herausforderung dar. So führt die klassische, sauer katalysierte Hydrolyse von Cellulose, technisch auch als Holzverzuckerung bezeichnet, zwar sehr effizient zur Depolymerisation der Celluloseketten in die einzelnen Glucoseeinheiten. Allerdings werden auch Folgereaktionen, ausgehend von Glucose, durch Säuren katalysiert. Daher entstehen zusätzlich zur Glucose als eigentlichem Zielmolekül durch Abspalten von Wasser noch 5-Hydroxymethylfurfural und Lävulinsäure sowie durch Repolymerisation so genannte Humine (Abb. 1) Letztgenannte sind wohl jedem aus leidlicher Erfahrung bei der heimischen Karamellherstellung bekannt. Zunächst schmilzt der Zucker in der Pfanne und ein gelblicher Farbton kommt zum Vorschein, der unter anderem durch 5-Hydroxymethylfurfural verursacht wird. Erhitzt man nun allerdings weiter und verpasst damit den richtigen Zeitpunkt, die Pfanne vom Herd zu nehmen, so nimmt die Schmelze zunehmend eine braune Farbe an und eine klumpige Struktur kommt zum Vorschein. Die besagten Humine sind entstanden. Eine Alternative zur klassischen Holzverzuckerung ist die kombinierte hydrolytische Hydrierung der Cellulose. Dabei wird Cellulose durch einen sauren Katalysator zu Glucose hydrolysiert, die an geträgerten Metallkatalysatoren direkt weiter zu dem entsprechenden Zuckeralkohol Sorbitol hydriert wird. Außerdem können so je nach Reaktionsbedingungen, Säurekonzentration und Metallkatalysator auch die Dehydratisierungsprodukte Sorbitan und Isosorbid erhalten werden, die sich insbesondere zur Herstellung von Tensiden eignen. Isosorbid könnte zukünftig aber auch Einsatz im Polymerbereich, z.B. bei PEIT (Polyethylenisosorbidterephthalat) – einer Entwicklung auf Basis von PET oder zur Produktion von Treibstoffadditiven – finden [3]. Daneben bietet die Kombination von Hydrolyse und Hydrierung auch die Möglichkeit, zu kurzkettigeren Produkten wie den C4–C5 Zuckeralkoholen Xylitol und Erytritol sowie C1–C3 Komponenten wie Glycerin, Propylen- und Ethylenglykol oder Methanol zu gelangen. Für diese Reaktion werden bifunktionelle Katalysatoren genutzt, die sowohl eine Säurefunktion als auch Metallzentren aufweisen und es so erlauben, Cellulose in einer Eintopfreaktion bis hin zu kurzkettigen Alkoholen zu zersetzen. In Abbildung 2 ist die Umsetzung von Fichtenholz mit diesem Verfahren illustriert. Als Säurekatalysator dienen dabei wasserlösliche Heteropolysäuren (HPA) wie Siliciumwolframsäure (SiW) oder Wolframatophosphorsäure (PW) in Kombination mit geträgerten Rutheniumkatalysatoren. Ausgehend von Holz kann dabei nicht nur der gesamte Anteil an Cellulose und Hemicellulose umgesetzt, sondern auch eine Ausbeute von 65 % an C4-C6 Zuckeralkoholen erreicht werden. Obwohl mit diesem Reaktionssystem bereits sehr gute Ergebnisse erzielt werden, soll im nächsten Schritt allerdings der feste Metallkatalysator um Säurezentren ergänzt werden, um die mit löslichen Säuren verbundenen Nachteile wie erschwertes Recycling bzw. Salzbildung durch Neutralisation zu vermeiden und die Nachhaltigkeit des Verfahrens weiter zu verbessern. Erdgas – ein wichtiger Rohstoff
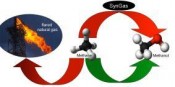
Auch bei der Nutzung konventioneller Rohstoffe sind längst nicht alle Probleme gelöst. So gibt es beispielsweise nach wie vor kein effizientes Verfahren, um Erdgas, das zum überwiegenden Teil aus Methan besteht, direkt in flüssige Produkte umzusetzen. Genau das wäre aber entscheidend, um auch Erdgas, das als Begleitgas in der Erdölförderung auftritt oder in kleinen bzw. abgelegenen Lagerstätten zu finden ist, nutzbar zu machen. Der Bau von Pipelines rechnet sich dabei meist nicht und auch andere Transportformen sind aufgrund der geringen Dichte und den damit verbundenen großen Volumina kaum wirtschaftlich. Entscheidend wäre hier ein Verfahren, das es erlaubt, Methan auch in kleinskaligen Anlagen in flüssige und damit gut transportable Produkte wie z.B. Methanol umzusetzen (Abb. 3). Bisher exi stieren aber nur Technologien, um Methan erst zu Synthesegas (H2/CO) und anschließend wiederum zu Methanol umzusetzen. Beide Schritte weisen einen signifikanten Größenskaleneffekt auf, sodass sich der Einsatz für kleinskalige Anwendungen nicht lohnt. Interessanterweise erreicht ein homogener Platinbipyrimidinkatalysator, auch als Periana-Katalysator bezeichnet, eine viel versprechende Aktivität und Selektivität in der Umsetzung von Methan zu Methylbisulfat in konzentrierter Schwefelsäure. Methylbisulfat kann anschließend einfach zu Methanol hydrolysiert werden. Das schwierige Recycling des homogenen Katalysators erschwert allerdings die kontinuierliche Prozessführung und damit eine kommerzielle Umsetzung des Verfahrens. Kürzlich ist es nun gelungen, mithilfe von triazinbasierten Hochleistungspolymeren einen neuartigen, festen molekularen Katalysator zu entwickeln, der vielleicht den ersten Schritt dazu darstellt, eine geeignete Technologie zur direkten Oxidation von Methan zu Methanol zu entwickeln (Abb. 4) [4]. Der Katalysator vereint dabei die vorteilhaften Eigenschaften von homogenen und festen Katalysatoren in sich. Er erreicht hohe Selektivität und Aktivität, lässt sich aber zugleich einfach abtrennen und wiederverwenden bzw. für eine kontinuierliche Reaktionsführung einsetzen. Damit öffnen sich bisher nicht da gewesenen Möglichkeiten der Prozessführung. So könnte es auf diesem Wege möglich werden, Erdgas direkt an der Quelle in Methanol umzusetzen und Transport und Lagerung dadurch deutlich zu vereinfachen. Energie und Katalyse – Schlusseltechnologien der Zukunft Ein anderer Bereich, der zukünftig von großer Bedeutung sein wird, ist die Speicherung von Energie, denn Solarstrom oder Windkraft liefern nicht bedarfsgerecht Strom wie z.B. Kohlekraftwerke, sondern abhängig von der jeweiligen Wetterlage. Damit werden aber Zwischenspeicher für riesige Energiemengen erforderlich, die eine entsprechende Energieüberproduktion abfangen und in produktionsschwachen Phasen die Grundversorgung garantieren. Eine viel versprechende Möglichkeit sind dabei chemische Energiespeicher. Bei einer Energieüberproduktion wird beispielsweise durch Wasserelektrolyse Wasserstoff erzeugt. Allerdings stellt auch die Zwischenspeicherung von Wasserstoff noch eine Herausforderung dar, sodass es sich anbietet, Wasserstoff an entsprechenden Katalysatoren entweder mit CO2 in Methanol oder sogar mit Stickstoff aus der Luft in Ammoniak umzusetzen und diese Komponenten als chemische Energiespeicher zu nutzen [5]. Sowohl Methanol als auch Ammoniak können bei Bedarf beispielsweise in Brennstoffzellen wieder rückverstromt werden. Eine echte Herausforderung stellt allerdings der dynamische Betrieb derartiger Prozesse dar. Bisher sind Anlagen der chemischen Industrie auf eine kontinuierliche Fahrweise mit konstanten Produktionsraten optimiert, während die Kopplung mit Energiebereitstellung und -speicherung zwangsläufig zum dynamischen Betrieb führt. Dementsprechend müssen neben effizienten Katalysatoren für die entsprechenden Anwendungen auch geeignete Verfahrenskonzepte entwickelt werden, sodass in Zukunft Prozess-, Verfahrenstechnik und Chemie noch enger miteinander verzahnt sein werden. [6] Zusammenfassung Die Katalyse rückt in der Zukunft näher an alle Fragen der Energieerzeugung und -speicherung. Damit wird sie als wichtiges Forschungsgebiet nicht nur die aktuellen Fragestellungen des Umweltschutzes oder der petrochemischen Industrie adressieren, sondern einen wichtigen Beitrag zu Fragen der Energie- und Rohstoffwende leisten und so aktiv an der Lösung zukünftiger gesellschaftlicher Herausforderungen mitwirken. Literatur
[1] Roadmap der deutschen Katalyseforschung: Katalyse – eine Schlüsseltechnologie für nachhaltiges Wirtschaftswachstum; Dechema, 3. Auflage, März 2010. Foto: © Prof. Dr. Regina Palkovits |
L&M 2 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |