&more

>
Don’t stop me now!
Don’t stop me now!
Die Rolle des Elongationsfaktors P (EF-P) bei der Translation von Polyprolinsequenzen
Die Translation eines Proteins stoppt, wenn drei aufeinanderfolgende Proline in die Polypetidkette eingebaut werden müssen. Dieser Translationsstopp wird durch die Aktivität des Elongationsfaktors P (EF-P) aufgehoben. EF-P und die orthologen Proteine IF-5A in Eukaryoten und Archaeen sind in allen Lebewesen vorhanden und für die effiziente Synthese vieler essenzieller Proteine notwendig.
Translation von Polypeptiden mit Polyprolinsequenzen
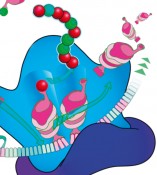
Die Translation, die Biosynthese eines Polypeptids, ist ein hochkonservierter Dreistufenprozess, bestehend aus einer einleitenden Phase (Initiation), einer Phase der Peptidkettenverlängerung (Elongation) und einer Stoppphase (Termination). Während der Elongation wird durch Verknüpfung der Aminosäuren die eigentliche Polypeptidkette synthetisiert. Allerdings ist das kein gleichförmiger Prozess. Vielmehr hängt die Synthesegeschwindigkeit entscheidend von der einzubauenden Aminosäure ab. Dabei verläuft die Knüpfung einer Peptidbindung mit Prolin besonders langsam. Die Translation von drei oder mehr aufeinanderfolgenden Prolinen ist so schwierig, dass es zu einem Synthesestopp am Ribosom kommt (Abb. 1). Trotzdem sind Proteine mit Polyprolinsequenzen nicht selten. Um einen ribosomalen Arrest bei der Synthese zu verhindern, haben nahezu ausnahmslos alle Lebewesen einen spezialisierten Translationselongationsfaktor evolviert. Dieser Faktor wird in Bakterien als Elongationsfaktor P (EF-P) und in Eukaryoten bzw. Archaeen als Initiationsfaktor 5A (IF-5A) bezeichnet.
Von der Entdeckung zur molekularen Funktion
Obwohl EF-P bereits 1975 als extraribosomaler Faktor identifiziert wurde, dauerte es fast 40 Jahre bis zur Klärung der molekularen Funktion [Übersicht in 1].
Meilensteine auf dem Weg lieferten vor allem die Arbeiten von Bernard Glick und Clelia Ganoza, die erste Hinweise auf eine spezialisierte Funktion des Proteins bei der Stimulierung der Peptidyltransferaseaktivität lieferten [2]. Bahnbrechend war die Aufklärung der 3D-Struktur von EF-P im Komplex mit dem 70S-Ribosom aus Thermus thermophilus im Jahr 2009 [3]. Mit seiner Drei- Domänen-β-Faltblattstruktur mimikriert EF-P zwar eine tRNA in Größe und Form, bindet aber nicht in gleicher Weise an das Ribosom. Stattdessen besetzt EF-P einen Platz zwischen der P-site (Peptidyl-tRNA-Bindestelle) und der E-site (Position, an der die tRNA das Ribosom verlässt) (Abb. 1). Blaha et al. folgerten daraus, dass EF-P für die korrekte Positionierung der Aminoacyl-tRNA notwendig sei [3].
Unsere Erkenntnisse zur Funktion von EF-P stammen aus der Erforschung der lysinabhängigen Säurestressadaptation in Escherichia coli, dem CadABC-System (Abb. 2) [4]. Dabei aktiviert der membranintegrierte pH-Sensor CadC im Zusammenspiel mit der Lysinpermease LysP in einer Umgebung mit niedrigem pH-Wert (pH<6,6) und gleichzeitiger Verfügbarkeit von Lysin die Transkription der beiden Zielgene cadB und cadA [5]. CadA katalysiert die Decarboxylierung von Lysin unter Verbrauch eines Protons zu Cadaverin und Kohlendioxid. Das Transportprotein CadB ist für die Aufnahme von Lysin in die Zelle und den gleichzeitigen Export des Cadaverins aus der Zelle verantwortlich. Die Säurestressadaptation wird zum einen durch den intrazellulären Verbrauch eines Protons und zum anderen durch Erhöhung des extrazellulären pH-Wertes infolge des Ausschleusens des alkalischen Cadaverins erreicht. In Mutanten, denen ein funktionales EF-P fehlt, ist die Proteinbiosynthese von CadC gestört und eine Säurestressadaptation findet nicht mehr statt. Mit CadC als erstem direkt EF-P-abhängigen Protein konnten wir die Funktionsweise von EF-P genauer untersuchen [4]. Im ersten Schritt konstruierten wir sogenannte CadC’-LacZ-Reporterproteine (β-Galaktosidase) unterschiedlicher Länge und verglichen kolorimetrisch deren Aktivität in E. coli efp+- und efp-Stämmen. Dadurch gelang es uns, ein Sequenzmotiv aus drei aufeinanderfolgenden Prolinen zu identifizieren, das die Abhängigkeit von EF-P verursacht (Abb. 2). Die Analyse weiterer LacZHybride sowie In-vitro-Translationsexperimente manifestierten die Funktion von EF-P als Translationselongationsfaktor, der spezifisch für die Aufhebung des Ribosomenstopps an Polyprolinsequenzen benötigt wird.
Mit einem biochemischen Ansatz gelangten Prof. Dr. Marina Rodnina und ihr Team vom MPI für Biophysikalische Chemie, Göttingen zeitgleich zu den gleichen Erkenntnissen [6]. Gutierrez et al. demonstrierten schließlich, dass auch das eukaryotische Ortholog IF-5A eine essenzielle Rolle bei der Translation von Polyprolinproteinen spielt [7]. Das E. coli-Proteom umfasst 95 Proteine, die ein Cluster von mindestens drei Prolinen haben. Dazu gehören neben CadC auch der Phosphatsensor PhoR sowie Proteine, die für die Zellteilung und den Metabolismus wichtig sind. Menschliche Zellen besitzen mehr als 4.000 Proteine mit einem Prolintriplett (circa 20 Prozent aller Proteine), was erklären könnte, warum Eukaryoten ohne IF-5A nicht lebensfähig sind.
Die Zahl der EF-P-abhängigen Proteine wird allerdings noch weit unterschätzt. Das wurde uns klar, als wir herausfanden, dass EF-P nicht nur für die Translation von Tripletts aus mindestens drei Prolinen, sondern auch in Abhängigkeit vom Aminosäurekontext für die Synthese von Diprolinmotiven (X/PP/X) wichtig ist [8]. In Verbindung mit einer systematischen In-vivo- und In-vitro-Analyse gelang es, die EF- P-abhängigen Arresttripletts hierarchisch zu ordnen: Eine besonders stark arretierende Wirkung haben PPP, D/PP/D, PPW, APP, G/ PP/G und PPN, während L/PP/L, CPP und HPP praktisch EF-P unabhängig sind. Diese Befunde wurden nicht nur für Salmonella enterica bestätigt [9], sondern mit einer Ribosomenprofilanalyse [10] sowie In-vivo-Zugkraft-Messungen am Ribosom [11] zusätzlich untermauert. Darüber hinaus wird die Stärke des translationalen Arrests nicht allein durch das zu translatierende X/ PP/X-Triplett, sondern auch durch stromaufwärts gelegene Aminosäuren sowie das Maß der Genexpression und die Lage des Motivs innerhalb der Polypeptidkette bestimmt [1, 12].

Abb.1 Modell der EF-P-vermittelten Knupfung der Prolin-Prolin-Peptidbindung: Die Bindung eines dritten konsekutiven Prolins an ein translatierendes Ribosom verursacht einen Ribosomenstopp. Der Translationselongationsfaktor P (EF-P) bindet an ein arretiertes Ribosom und stimuliert die Bildung der Prolin-Prolin-Peptidbindung. Dadurch wird der Stopp aufgehoben und die Translation wird mit der Anlieferung der nachsten AminoacyltRNA fortgesetzt.
Die Evolution von EF-P und IF-5A
EF-P und IF-5A sind ubiquitär verbreitet. Selbst in Bakterien mit einem sehr kleinen Genom, aber auch in den meisten obligaten Endosymbionten findet man ein entsprechendes Gen [11]. Die Tatsache, dass die Natur einen spezialisierten Translationsfaktor EF-P/IF-5A überhaupt evolviert hat, impliziert, dass der Nutzen einer integralen Polyprolinsequenz die Schwierigkeiten seiner Synthese mehr als ausgleicht. Das wiederum wirft die Frage nach dem Ursprung des Arrestdilemmas auf. Wir analysierten insgesamt 1.576 sequenzierte bakterielle, archaeale und eukaryotische Genome und identifizierten dabei die ValyltRNA- Synthetase ValS als einziges Protein mit einem phylogenetisch invarianten Prolintriplett [13]. Das Prolintriplett von ValS ist integraler Bestandteil des aktiven Zentrums und unabdingbar, um die Valyl-tRNA effektiv zu beladen bzw. eine Fehlbeladung mit Threonin zu verhindern. Anhand der Tatsache, dass ohne EF-P die ValS-Synthese drastisch reduziert und ValS ein essenzielles Protein ist, spekulieren wir, dass EF-P und IF-5A initial für dessen Translation evolviert wurden [13].
Während das Prolintriplett in ValS von immanenter struktureller Bedeutung für die enzymatische Funktion ist, haben andere Polyprolinsequenzen wie in CadC eine eher regulatorische Funktion. So hängt eine adäquate Säurestressantwort vom Proteinmengenverhältnis zwischen dem pH-Sensor CadC und seinem Lysin-Co- Sensor LysP ab (Abb. 2). Durch Substitution der CadC-Polyprolinsequenz wird dieses Mengenverhältnis zu Gunsten von CadC gestört und es kommt zu einer Stimulus-unabhängigen Expression der Zielgene cadBA. Damit sind der Proteinmenge von CadC pro Zelle enge Grenzen gesetzt, die ihrerseits nur durch eine EF-P-abhängige Translation eingehalten werden können. Polyprolinsequenzen stellen so eine Möglichkeit dar, um gezielt die Menge einzelner Proteine feinzujustieren [1, 4].
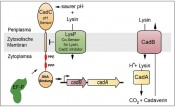
Abb.2 Das CadABC-System von E. coli, einem lysinabhangigen Saurestress-Adaptationssystem. Das System besteht aus dem pH-Sensor und Transkriptionsaktivator CadC, dem Lysin-Co-Sensor LysP, der Lysindecarboxylase CadA und dem Lysin/Cadaverin-Antiporter CadB. CadC setzt sich aus einer periplasmatischen pH-Sensordomane, einer Transmembranhelix, einer cytoplasmatischen Linker- Region und einer DNA-Bindedomane zusammen. Die Linkerregion enthalt die EF-P-abhangigen Sequenzmotive Prolin-Prolin-Prolin (PPP) und Prolin-Prolin-Glutamat (PPE).
Abb.3 Diversitat der EF-P/IF-5A Modifikationssysteme A: Mittels der Deoxyhypusin-Synthase wird ein konservierter Lysinrest des eukaryotischen bzw. archaealen IF-5A in einem ersten Schritt mit der 4-Aminobutylgruppe aus Spermidin verknupft. In einem zweiten Schritt findet eine durch die Deoxyhypusin- Hydroxylase vermittelte Hydroxylierung von Deoxyhypusin zu Hypusin statt. B: In Bakterien, wie z.B. Escherichia und Salmonella, wird durch die Aminomutase EpmB zuerst (S)- α-Lysin zu (R)-β- Lysin isomerisiert, bevor dieses durch die EpmA-katalysierte Reaktion an Lysin34 in EF-P- geknupft wird. Im Anschluss wird das β-lysinylierte Lysin durch EpmC hydroxyliert. C: In Bakterien, wie z.B., Shewanella und Pseudomonas, ist das konservierte Lysin durch ein Arginin in EF-P ersetzt, welches durch die EarP-katalysierte Reaktion unter Benutzung von dTDP-Rhamnose als Substrat rhamnosyliert wird.
Posttranslationale Aktivierung von EF-P und IF-5A
Die Aktivität von EF-P als auch IF-5A wird durch posttranslationale Modifikationen (PTMs) reguliert (Abb. 3). Dabei wird eine positiv geladene Aminosäureseitenkette an der Spitze einer Loop-Region in Domäne I verlängert. Die PTMs ermöglichen zusätzliche Interaktionen mit dem aminoacylierten Ende der P-site tRNA, reichen aber nicht ins Peptidyltransferasezentrum. Vielmehr scheint EF-P die Bildung der Peptidbindung indirekt zu stimulieren, indem es die P-site tRNA stabilisiert und korrekt positioniert [1, 14].
In IF-5A wird ein konservierter Lysinrest zur ungewöhnlichen Aminosäure Hypusin [Nε-(4- Amino-2-hydroxybutyl)lysin] posttranslational verlängert. Der Umbau erfolgt in zwei Katalyseschritten durch die Enzyme Deoxyhypusin- Synthase (DHS) und Deoxyhypusin-Hydroxylase (DOOH) (Abb. 3A) [Übersicht in 1]. Bakterien haben verschiedene Strategien zur Aktivierung von EF-P evolviert [Übersicht in 1]. So wird in E. coli und S. enterica ebenfalls ein Lysinrest an der ε-Aminogruppe zu (R)-β- Lysinyl-hydroxy lysin verlängert (Abb. 3B). Dazu wird in einem ersten Schritt (S)-α-Lysin durch die Lysinaminomutase EpmB (auch als YjeK bekannt) zu (R)-ε-Lysin isomerisiert. ( R)-ε-Lysin wiederum dient als Substrat für die EF-P Lys34-Lysyltransferase EpmA (auch als YjeA, PoxA und GenX bekannt). Interessanterweise leitet sich EpmA phylogenetisch von einer Typ II Lysyl-tRNA-Synthetase LysRS ab, die im Laufe der Evolution die Substratspezifität für tRNA durch Verlust der Antikodonbindedomäne verloren hat und stattdessen nun das strukturanaloge EF-P modifiziert. Anschließend kann Lysin noch durch die Aktivität von EpmC hydroxyliert werden. Ebenso wie in Eukaryoten ist die Bedeutung der Hydroxylierung nicht vollständig geklärt. Vermutlich erfüllt diese eine akzessorische Rolle zur Stabilisierung von Wechselwirkungen über Wasserstoffbrückenbindungen.
Orthologe Proteine zu EpmA und EpmB findet man allerdings nur in ca. 25 Prozent aller Bakterien. Kürzlich gelang es uns, eine völlig neuartige bakterielle Modifikationsstrategie von EF-P zu identifizieren, die auch in dem Erreger der bakteriellen Lungenentzündung P. aeruginosa sowie in Gono- und Meningokokken vorkommt [15]. In diesen Organismen besitzt EF-P anstelle des Lysins ein positionsäquivalentes Arginin, das durch die neuartige Glykosyltransferase EarP rhamnosyliert wird. Als aktiviertes Substrat für die Reaktion dient dTDP-L-Rhamnose, die unter anderem auch bei der Biosynthese von Rhamnolipiden verwendet wird, die wiederum in P. aeruginosa einen wichtigen Virulenzfaktor darstellen. Mit unserer Entdeckung lieferten wir nicht nur das erste Beispiel zur Arginin-Glykosylierung in Bakterien, vielmehr ist die Aktivierung von EF-P auch zur Ausprägung von Pathogenität notwendig. Damit bilden die EF-P-Modifikationssysteme neue attraktive Angriffspunkte, um Antibiotika zur selektiven Hemmung einzelner Organismengruppen zu entwickeln. So könnten unsere Forschungsergebnisse helfen, dem Problem der wachsenden Multiresistenz entgegenzutreten.
-> jung@lmu.de
-> juergen.lassak@lmu.de
Foto: © wickipedia.com| Matt, LadyofHats Literatur
[1] Lassak, J. et al., (2015), Mol. Microbiol.
[2] Glick, B. R. et al., (1979), Eur J Biochem, 97, 23–28
[3] Blaha, G. et al., (2009), Science, 325, 966–970
[4] Ude, S. et al., (2013), Science, 339, 82–85
[5] Tetsch, L. et al., (2008), Mol Microbiol, 67, 570–583
[6] Doerfel, L. K. et al., (2013), Science, 339, 85–88
[7] Gutierrez, E. et al., (2013), Mol Cell, 51, 35–45
[8] Peil, L. et al., (2013), Proc Natl Acad Sci USA, 110, 15265–15270
[9] Hersch, S. J. et al., (2013), mBio, 4, e00180-00113
[10] Woolstenhulme, C. J. et al., (2015), Cell reports, 11, 13 –21
[11] Cymer, F. et al., (2015), J Biol Chem, 290, 10208 –10215
[12] Starosta, A. L. et al., (2014), Nucleic acids research, 42, 10711–10719
[13] Starosta, A. L. et al., (2014), Cell reports, 9, 476–483
[14] Schmidt, C. et al., (2015), Nucleic Acid Res.
[15] Lassak, J. et al., (2015), Nat Chem Biol, 11, 266–270
|
L&M 2 / 2016
Diese Artikel wurden veröffentlicht in Ausgabe L&M 2 / 2016.
Das komplette Heft zum kostenlosen Download finden Sie hier:
zum Download
Die Autoren:
Weitere Artikel online lesen
News
Mit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!
© Text und Bild: Altmann Analytik
Aufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508
ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen.
© Text und Bild: Carl Zeiss Microscopy GmbH
|
 >
Don’t stop me now!
>
Don’t stop me now!




















