|
Medizin
 >
Fraktionierung funktioneller Peptide mittels ionenaustauschbasierter Membranadsorptionschromatografie
>
Fraktionierung funktioneller Peptide mittels ionenaustauschbasierter Membranadsorptionschromatografie
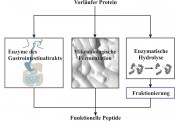
Fraktionierung funktioneller Peptide mittels ionenaustauschbasierter MembranadsorptionschromatografieTrennung durch BindungDurch Einsatz spezifischer Proteasen können Proteine mehr oder weniger gezielt hydrolysiert werden. Dabei können funktionelle Peptide freigesetzt werden, die bspw. eine blutdrucksenkende Wirkung oder grenzflächenaktive Funktion aufweisen. Der Einsatz biofunktioneller Peptide in Lebensmitteln als „added value“ ist jedoch nur mit einer ausreichenden Wirkkonzentration möglich. Daher sind Prozesse erforderlich, die eine Gewinnung und selektive Anreicherung der funktionellen Peptide ermöglichen. Arterielle Hypertonie, im Volksmund auch als Bluthochdruck bekannt, ist einer der Hauptrisikofaktoren für Herz-Kreislauf-Erkrankungen. Eine Behandlung der Krankheit erfolgt derzeit durch eine Hemmung des Angiotensin Converting Enzyme (ACE), dem als Schlüsselenzym im Renin-Angiotensin-System eine bedeutende Rolle zugewiesen wird. Es katalysiert durch die Abspaltung eines Dipeptids die Umsetzung von Angiotensin I zu Angiotensin II und bewirkt somit einen Blutdruckanstieg. So wird durch den Einsatz von ACE-Hemmern schon seit mehreren Jahren erfolgreich arterielle Hypertonie behandelt. Da diese Medikamente oft Nebenwirkungen zeigen, ist der Einsatz von ACE-Inhibitoren in geringeren Konzentrationen in Lebensmitteln von großem Interesse. Dabei weisen so genannte funktionelle Lebensmittel neben ihrer nutritiven Funktion einen zusätzlichen positiven Nutzen für die Gesundheit des Menschen auf. Um einen solchen Effekt erzielen zu können, sind jedoch ausreichende Konzentrationen der funktionellen Peptide in den entsprechenden Lebensmitteln erforderlich. Gewinnung funktioneller Peptide Die Freisetzung funktioneller Peptide aus Proteinen kann auf verschiedene Arten erfolgen (Abb.1). Dabei ist zunächst der Einsatz eines geeigneten Vorläuferproteins notwendig, durch dessen Proteolyse die in der Aminosäuresequenz enthaltenen Peptide freigesetzt werden. Milchproteine und speziell Molkenproteine haben sich dabei in den letzten Jahren der Forschung als Vorläuferproteine für eine Vielzahl an funktionellen Peptiden hervorgetan. So kommt es bereits während der Verdauung dieser Proteine im Gastrointestinaltrakt zur Freisetzung einer Reihe aktiver Peptide, deren Konzentration jedoch zu gering ist, um einen signifikanten positiven Effekt zu erreichen.
Abb.1 Gewinnung funktioneller Peptide durch Proteolyse.
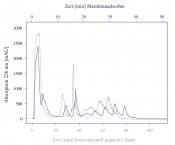
Ein Verfahren, mit dem gezielt eine Freisetzung funktioneller Peptide aus Milchproteinen erreicht werden soll, ist die Fermentation mit spezifischen Starterkulturen. Dabei kommt es durch die Enzyme der Mikroorganismen zu einer verstärkten Produktion der ACE-inhibitorischen Peptide IPP und VPP. So wurden für den finnischen Markt eine Reihe fermentierter Milchprodukte entwickelt, denen in klinischen Studien eine leichte blutdrucksenkende Wirkung nachgewiesen werden konnte. Ist jedoch ein Einsatz solch funktioneller Peptide in anderen Lebensmitteln gewünscht, ist eine Zugabe zum Lebensmittel erforderlich. Eine Möglichkeit, funktionelle Peptide aus natürlichen Rohstoffen zu gewinnen, ist die enzymatische Hydrolyse. So wird beispielsweise durch tryptische Hydrolyse des majoren Molkenproteins ß-Lactoglobulin die Freisetzung der ACE-inhibitorischen Peptide f(9–14) und f(142–148) ermöglicht [1]. Fraktionierung von Hydrolysaten Jedoch entsteht bei enzymatischen Hydrolysen stets ein komplexes Gemisch an unterschiedlichen Peptiden, selbst unter Einsatz spezifischer Enzyme und konstanten Reaktionsbedingungen. Dabei können die Hydrolysate neben den gewünschten Peptiden ebenfalls Peptide mit negativen Eigenschaften wie beispielsweise einem bitteren Geschmack enthalten. Daher sind zusätzlich zur Freisetzung der funktionellen Komponenten Verfahren erforderlich, die eine Abtrennung anderer und die Anreicherung der bioaktiven Peptide erlauben. Da jedoch die Peptide des tryptischen Totalhydrolysats von ß-Lactoglobulin ähnliche Molekulargewichte aufweisen, ist eine Trennung der Peptide durch etablierte Trennverfahren wie beispielsweise der Membranfiltration kaum möglich. Es sind also Verfahren erforderlich, die eine Fraktionierung der Moleküle, basierend auf ihren spezifischen physikalisch-chemischen Eigenschaften, ermöglicht. Solch eine selektive Fraktionierung einzelner Komponenten aus einem komplexen Peptidgemisch ist derzeit nur mithilfe gepackter Chromatografiesäulen etabliert. Diese Verfahren sind jedoch in ihrem Durchsatz stark limitiert. Eine neue leistungsfähige Alternative zur klassischen Flüssigchromatografie stellt die Membranadsorbtionschromatografie (MAC) dar (siehe Infobox). Ionenaustauschbasierte Membranadsorptionschromatografie Um eine selektive Trennung der ACE-inhibitorischen Peptide aus dem komplexen ß-Lactoglobulin Hydrolysat zu ermöglichen, wurde eine ionenaustauschbasierte Membranadsorptionschromatografie (IE-MAC) eingesetzt. Die Analyttrennung erfolgt bei der MAC prinzipiell wie bei der klassischen Ionenaustauschchromatografie. Jedoch liegen die Vorteile der MAC in deutlich größeren realisierbaren Flussraten und einer verringerten Prozesszeit [3]. Dies konnte auch bei der Fraktionierung von Hydrolysaten unter Einsatz verschiedener Anionenaustausch-Chromatografiesäulen in Form einer konventionell gepackten Säule und eines Membranadsorbers gezeigt werden. In Abbildung 2 sind die Chromatogramme beider Fraktionierungsverfahren dargestellt. Während beim Einsatz der gepackten Chromatografiesäule die Fraktionierung des Hydrolysats erst nach etwa 80min abgeschlossen war, konnte eine Trennung der Fraktionen mithilfe des Membranadsorbers in bereits 40min erzielt werden. Zudem wurde bei der MAC trotz höherer Flussraten eine bessere Trennschärfe der einzelnen Fraktionen erreicht. Dank dieser Eigenschaften und des durch die Modulbauweise der Membranadsorber leicht realisierbaren up-scales stellt die MAC ein selektives und wirtschaftlich interessantes Trennverfahren für die Lebensmittelindustrie dar.
Abb.2 Vergleich der Fraktionierung eines ß-Lactoglobulin-Hydrolysats unter Einsatz der konventionell gepackten Anionenaustauschersäule „Mono Q 5/50 GL“ (graue Linie) und des membranbasierten Anionenaustauschers „Sartobind Q“ (blaue Linie); Fraktionierungsbedingungen: 0.03M Phosphat Puffer, pH7, Flussrate Mono Q: 1ml/min, Flussrate Sartobind Q: 5ml/min.
Fraktionierung des tryptischen ß-Lactoglobulin-Hydrolysats Als Ausgangssubstrat für den Fraktionierungsprozess diente das Totalhydrolysat der tryptischen Hydrolyse von ß-Lactoglobulin, das neben den genannten ACE-inhibitorischen Peptiden 17 weitere Peptide enthält. Das optimierte Verfahren zur Fraktionierung des Hydrolysats mittels IE-MAC beinhaltet im ersten Schritt den Einsatz eines Anionenaustauschers (AE). Durch die komplexe Zusammensetzung des Hydrolysats und die damit verbundene große Bandbreite der isoelektrischen Punkte binden nicht alle Peptide an den AE und werden als Flowthrough (AE FT) aufgefangen. Dagegen binden Peptide mit einer negativen Ladung an den AE und können durch einen Ionenstärkegradienten in insgesamt sieben Fraktionen (AE1–AE7) getrennt werden. In einem zweiten Schritt wird der AE FT auf einen Kationenaustauscher (CE) aufgegeben und es werden wiederum unter Einsatz eines Ionenstärkegradienten fünf Fraktionen (CE1–CE5) gewonnen. Zusätzlich wird in diesem Schritt ebenfalls eine Fraktion mit nicht bindenden Peptiden im Flowthrough des Kationenaustauschers (CE FT) gewonnen. Somit wird unter Einsatz beider Ionenaustauscher eine Fraktionierung des Hydrolysats in 13 Fraktionen ermöglicht. Um den Fraktionierungserfolg beurteilen zu können, war zunächst die Bestimmung der Peptidzusammensetzung der einzelnen Fraktionen notwendig. Mittels Massenspektrometrie wurden die in den Fraktionen enthaltenen Peptide quantifiziert und die Ausbeute der ACE-inhibitorischen Peptide f(9–14) und f(142–148) als prozentualer Anteil des eingesetzten Hydrolysats berechnet. In Abbildung 3 sind die ermittelten Chromatogramme der Chromatografieprozesse sowie der prozentuale Anteil der Zielpeptide in den einzelnen Fraktionen dargestellt. [4]
Abb.3 Chromatogramme des entwickelten Fraktionierungsprozesses mittels gekoppelter anionen- (A) und kationenaustausch- (B) basierter Membranadsorptionschromatografie sowie die prozentuale Ausbeute der ACE-inhibitorischen Peptide f(9–14) und f(142–148) in den gewonnenen Fraktionen (modifiziert nach [4]).
Wie deutlich wird, konnte eine erfolgreiche Anreicherung der ACE-inhibitorischen Peptide vor allem in den Fraktionen des Kationenaustauschers ermöglicht werden. Dabei wird das Peptidfragment f(9–14) vor allem im Flow Through (CE FT), d.h. in der Fraktion nicht bindender Peptide, und der ersten Fraktion (CE1) angereichert, während das Peptid f(142–148) vor allem in der zweiten (CE2) und dritten (CE3) Fraktion des Kationenaustauschers wiederzufinden ist. Um antagonistische Effekte anderer in den Fraktionen enthaltener Peptide auf die ACE-inhibitorische Wirkung auszuschließen, wurde die ACE-inhibitorische Aktivität der Fraktionen in vitro untersucht.
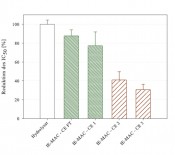
Abb.4 Reduktion der IC50-Werte der mittels Kationenaustauscher gewonnenen Fraktionen im Vergleich zum initial eingesetzten Hydrolysat; CE FT: Flowthrough des Anionenaustauschers, CE 1–CE 3: Fraktionen 1–3 des Anionenaustauscher Prozesses (modifiziert nach [5]).
In-vitro-Analyse der ACE-inhibitorischen Aktivität Dabei wurde die inhibitorische Wirkung des Hydrolysats insgesamt sowie der gewonnenen Fraktionen mit maximalem Gehalt an ACE-inhibitorischen Peptiden anhand der Ermittlung ihrer IC50-Werte bestimmt. Der IC50 ist dabei die Konzentration, bei der eine halbmaximale Inhibierung des ACE erreicht wird. Mit sinkenden IC50-Werten wird somit eine Steigerung der ACE-inhibitorischen Wirkung dargestellt. In Abbildung 4 ist die Reduktion der IC50-Werte der untersuchten Fraktionen mit maximalem Gehalt an den ACE-inhibitorischen Peptiden f(9–14) und f(142–148) im Vergleich zum Totalhydrolysat angegeben. Wie zu erkennen ist, wird durch eine Fraktionierung des Hydrolysats mittels IE-MAC eine deutliche Steigerung der ACE-inhibitorischen Eigenschaften erreicht. So wird bspw. für die Fraktion CE2 eine Reduktion des IC50-Werts auf 40% und die Fraktion CE3 eine Reduktion auf 30% ermittelt. Die vorliegenden Ergebnisse machen deutlich, dass die IE-MAC erfolgreich zur Fraktionierung ACE-inhibitorischer Peptide aus dem komplexen ß-Lactoglobulin-Hydrolysat eingesetzt werden kann. Die dabei gewonnenen Fraktionen könnten anschließend im Rahmen von klinisch bzw. sicherheitsgeprüften Lebensmitteln (funktionelle Lebensmittel, ggf. Novel Food) als blutdrucksenkende Peptide eingesetzt werden. Literatur
[1] Pihlanto-Leppälä, A. et al. (1998) Int. Dairy J. 4, 325 –331 Bild: © istockphoto.com| Lise Gagne |
L&M 7 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |