|
Modellierung der Wechselwirkung von Nahrungsinhaltsstoffen mit Proteinen
Modellierung der Wechselwirkung von Nahrungsinhaltsstoffen mit ProteinenBiomarker in der ErnährungswissenschaftDie Modellierung von molekularen Wechselwirkungen (Molecular Modeling) hat sich in den letzten Jahrzehnten als Standardmethode bei der Entwicklung von Wirkstoffen etabliert. Am Institut für Ernährungswissenschaft der Universität Potsdam werden in einem interdisziplinären Forschungsschwerpunkt Molecular-Modeling-Methoden angewandt für die Bewertung des Verhaltens von ernährungsrelevanten Verbindungen auf molekularer Ebene. Die Charakterisierung solcher Interaktionen zusammen mit funktionellen Daten aus etablierten biochemischen und physiologischen Testverfahren tragen wesentlich zu einem besseren Verständnis der Bedeutung einzelner Inhaltsstoffe der Nahrung für die Prävention ernährungsabhängiger Krankheiten, wie Herz-Kreislauf-Erkrankungen, Krebs, Diabetes mellitus sowie neurodegenerativer Erkrankungen bei. Im Mittelpunkt der Forschungsstrategie steht somit auch die Bewertung von Biomarkern für die gesundheits- fördernde oder gesundheitsschädigende Wirkung von Nahrungsinhaltsstoffen. Der erste Ansatz konzentriert sich auf die Identifizierung und Charakterisierung von Proteinen mittels Standardtechnologien der Proteomforschung, die ein sogenanntes Proteinprofiling oder -mapping erlauben. Der zweite Ansatz bewertet die Veränderungen der Proteinstruktur und damit gegebenenfalls die Funktion von Proteinen durch einzelne Nahrungsbestandteile, was sich unter dem Begriff „Functional Proteomics“ zusammenfassen lässt. Durch eine Interaktion von Nahrungsbestandteilen mit einzelnen Proteinen kann es somit neben einer Veränderung der Proteinstruktur, was sich in einer Mikroheterogenität des Proteins ausdrücken kann, auch zu Veränderungen in der Wechselwirkung zwischen den Proteinen kommen. Veränderungen im Proteom können sowohl als Biomarker oder Surrogatendpunkte für die gesundheitsfördernde Wirkung einzelner Nahrungsinhaltsstoffe als auch für den Schweregrad einer Erkrankung genutzt werden. Ferner können identifizierte molekulare Strukturen Zielmoleküle („Targets“) für nutritive Stoffe sein. Strukturen für Biomarker und Targets sind vor allem Peptide und Proteine. Neben der Wirkung einzelner Nahrungskomponenten auf die Expression von Proteinen ist vor allem die Interaktion von Nahrungsinhaltsstoffen mit dem Proteom selbst von erheblicher Bedeutung. Wechselwirkungen von Nahrungsinhaltsstoffen mit bestimmten Proteinen können zu Veränderungen tertiärer Proteinstrukturen führen. Infolge der Strukturveränderungen kann beispielsweise die Aktivität eines Enzyms oder die Fähigkeit der Interaktion zwischen Makromolekülen (Protein/Protein) und „small Molecules“ (Proteinrezeptor/Ligand) verändert werden. In Bezug auf bioaktive Nahrungsinhaltsstoffe sind neben nichtkovalenten Modifikationen auch kovalente zu erwarten. Derartig modifizierte Moleküle können aber auch potenzielle „Nutritional Targets“ sein, an die, ähnlich den „Drug Targets“ als Zielmoleküle im Blut oder in Körperzellen, bioaktive Wirkstoffe spezifisch binden und dadurch Effekte auslösen. Hinzu kommt, dass Proteine ihre Funktion in vielen Fällen im Verbund mit anderen Biomolekülen als Liganden erfüllen. Diese Moleküle können andere Proteine (Protein-Protein-Wechselwirkungen) oder Metabolite („small molecule protein interaction“) sein und somit erfasst im weitesten Sinne die Richtung „Interactomics“. Ein wesentlicher Unterschied zur Pharmaforschung besteht darin, dass Veränderungen an Nahrungsbestandteilen (Proteinen) extra-korporal untersucht werden, bedingt durch lebensmitteltechnologische Prozesse. Das Ziel der Forschungsaktivitäten des Molecular Modeling basiert auf dem konzeptionellen und analytisch-experimentellen Ansatz der Charakterisierung der Interaktion von Nahrungsbestandteilen und Metaboliten mit verschiedenen Proteinen. Gängige Methoden des Molecular Modeling sind das Docken (Ligand an Target; Protein/Protein), Molekulardynamik-Untersuchungen, und die Homologie-Modellierung von Proteinen. An einigen Beispielen aus unserer Forschung sollen diese Methoden vorgestellt werden. Docking-Molekulardynamik-Untersuchungen an Kaffeeproteinen
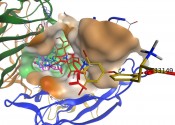
Als Kaffee bezeichnet man die Samen der Gattung Coffea, die von der Frucht- und Samenschale befreit sind. Die Speicherproteine in den Samen machen den größten Anteil des Gesamtproteinanteils aus. Die Hauptfraktion ist ein globuläres 11S Protein, das ein Hexamer darstellt. Die sechs Untereinheiten von ca. 58 kDa lassen sich jeweils unter reduzierenden Bedingungen in eine a- und eine ß-Untereinheit aufspalten. Kaffeebohnen werden zu den chlorogensäurereichsten Lebensmitteln gezählt. Eine Eigenschaft solcher phenolischen Verbindungen ist deren Anfälligkeit gegenüber Oxidation. Dadurch sind post-harvest- (in der Reifungsphase und nach der Ernte) Reaktionen mit Kaffeeproteinen möglich. Im Verlauf von Verarbeitungs- und Lagerungsprozessen können phenolische Komponenten pflanzlicher Lebens- mittel mit den Aminosäuren der Proteine in Lebensmitteln reagieren. Solche Reaktionen können die physikalisch-chemischen Eigenschaften von Proteinen und deren ernährungsphysiologische Wertigkeit verändern. Proteine weisen verschiedene reaktive Seitengruppen (Thiol-, Hydroxyl-, Aminogruppen) auf, mit denen sie über kovalente und nicht-kovalente Wechselwirkungen mit phenolischen Verbindungen eingehen können. Die Ergebnisse belegen eine umfangreiche und sehr heterogene Adduktbildung mit den Aminoseitenketten des Lysins und des Cysteins (Cys). Ein Katalog der unterschiedlichen Reaktionsprodukte wurde erstellt und solche Reaktionsmöglichkeiten in den grünen Kaffeebohnen lokalisiert und modelliert. Dazu wurde zunächst das Kaffeeprotein modelliert (Homologes Modell ausgehend von PDB Vorlagen: 3FZ3-B-D, 2D5F-B, und 3C3V-A (monomer) und 3KSC, 2E9Q, and 1UD1 (Trimer); Datenbankeintrag Proteindatenbank pdb – http:/ Die Details zu den Herangehensweisen sind in [1] beschrieben und Abb.1 stellt mögliche Proteinmodifikationen im Kaffeeprotein dar.
Abb.1 Darstellung der möglichen Stellen für Proteinmodifikationen in Kaffeespeicherprotein adaptiert aus [1].
„Steered“ (gesteuerte) Molekulardynamik am Beispiel von Transthyrethrin Transthyretin (TTR) ist ein evolutionär hochkonserviertes Transportprotein für Schilddrüsenhormone (T3, T4) und Retinol (im Komplex mit RBP4), das beim Menschen im Blut und im Liquor cerebrospinalis vorkommt [2]. Es handelt sich um ein Homotetramer, dessen Untereinheiten aus je 127 Aminosäuren bestehen und einen hohen Anteil an ß-Faltblatt-Strukturen hat [3]. Für TTR ist inzwischen eine Vielzahl von Röntgenstrukturen bekannt. Bisher wurden hierbei weitgehend Standardmethoden des Molecular Modelings zum Einsatz herangezogen (Docking; homologes Modellieren, Proteindesign). Um den Einfluss der posttranslationalen Proteinmodifikation (PTM) auf den Transport der Schilddrüsenhormone mit dem TTR zu untersuchen, kam das Verfahren der „steered“ Molekulardynamik (SMD) zur Anwendung. Dieses Herangehen bietet eine Möglichkeit, die Dynamik zwischen Bindung und Dissoziation eines biomolekularen Systems zu untersuchen und in unserem Fall die Geschwindigkeit des T3/T4-Austritts und dessen Interaktionen mit den unterschiedlich modifizierten TTR zu untersuchen. Wir konnten mit dieser Methode nachweisen, dass die PTMs einen wesentlichen Einfluss auf die Austrittsgeschwindigkeit des Schilddrüsenhormons aus seiner Bindungsposition haben. Das resultiert zu einem aus der Interaktion des Proteins mit den sich ändernden Liganden und zum anderen auch aus auftretenden Veränderungen am Austrittskanal, die soweit gehen können, dass dieser geschlossen wird. Das kann in den Zusammenhang von Hypo- und Hyperthyreose gebracht werden. In Abbildung 2 ist der Weg des T3 aus TTR aufgezeigt.
Abb.2 T3-Austritt aus TTR. dargestellt ist die Molekularoberfläche um den Austrittskanal. Man kann sehen, das sich die Umgebung von lipophil (grün) nach hydrophil (gold) ändert. Neutrale oder geringer ausgeprägte Eigenschaften sind weiß bzw. heller dargestellt. Weitere Details finden sich in [4].
Homologiemodellierung und Docking-/Bindungsuntersuchungen am Sphingosinphosphatrezeptor Die Sphingosin-1-phosphat-Rezeptoren (S1P1 – S1P5) sind membranständige G-Protein-gekoppelte Rezeptoren, die der Klasse A (Rhodopsinähnliche) zugeordnet werden. Der native Ligand für diese Rezeptoren ist das Sphingosin-1-phosphat (S1P). Die S1P-Rezeptoren werden durch S1P reguliert und unterliegen damit einer autokrinen und parakrinen Regulation mit intrazellulären und extrazellulären Wirkungen. S1P vermittelt zahlreiche physiologische Wirkungen im Organismus und ist auch an pathophysiologischen Veränderungen beteiligt. Eine besondere Bedeutung besitzt S1P im immunologischen Geschehen. Über eine Bindung an dem S1P1 Rezeptor ist es für die Zirkulation von Lymphozyten zwischen Blut, Lymphe und Lymphknoten verantwortlich. Dies hat zur Einführung eines neuen Arzneistoffs, dem Fingolimod in der Therapie der multiplen Sklerose, geführt.
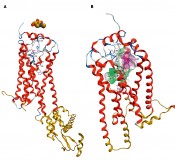
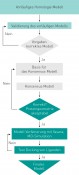
Michael A. Hanson et al. veröffentlichten die Röntgenstruktur von S1P 2012 in einem Science Paper. Die Strukturauflösung lag um 3 Å. Für unsere Untersuchungen nutzen wir die veröffentlichte Struktur 3V2W (Abb.3a, Pdb-Code – http:/ S1P1 wurde zur Kristallisation mit T4-lysozym fusioniert, um eine stabile Proteinstruktur für die Kristallisation zu erhalten (Abb.3). Um eine für unsere Untersuchungen geeignete Struktur zu haben, mussten Fehler der Röntgenstruktur und das Fusionsprotein entfernt werden. Es wurde dafür ein kombinierter Prozess des homologen Modellierens – MD Kalkulationen „Indukted Fit“ docking (Indukted Fit: das Protein ist ebenso wie der zu untersuchende Ligand strukturell flexibel) – verwendet. Dieses Vorgehen ergab sich aus der relativ schlechten Auflösung der Röntgenstruktur. Das Homologmodell wurde dann nach den bei uns erprobten Verfahrensschritten erstellt (Abb.4, Ablaufschema).
Abb.3 Die Startstruktur aus Hanson et al. [6]; Finale Struktur des neu berechneten S1P1 Gold eingefärbt; Fehler bei Startstruktur; final neu berechnete Stellen. A) Ausgangs Modell Pdb 3V2Y, B) Finales Modell S1P1
Abb.4 Verfahrensschritte zur Entwicklung eines Homolog-Modells
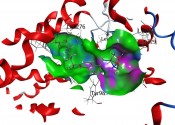
Das von uns entwickelte Modell konnte dann zur Untersuchung von neuen potenziellen Liganden an den S1P1 eingesetzt werden. Es konnte mit diesem Rezeptormodell gezeigt werden, dass die neuen „Schmetterlingsverbindungen“ (Weiterentwicklungen des immunmodulierenden Fingolimods – FTY720) in der Lage sind, an den S1P1-Rezeptor zu docken (Abb. 5) [5].
Abb.5 Bindung von „Schmetterlingsverbindungen“ an den S1P1 vgl. [5]
Diese wenigen Beispiele zeigen, dass neue Zusammenhänge zwischen der Aufnahme verschiedener Nahrungsinhaltsstoffe, ihren Metaboliten und ihren Wechselwirkungen mit Proteinen mittels Molecular Modeling exzellent dargestellt werden, um die Auswirkungen auf bestimmte Krankheiten zu charakterisieren und somit einen Beitrag zu deren Prävention zur Ursachenerkennung zu liefern.
Literatur © istockphoto.com|?sdominick, Floortje |
L&M 1 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |