|
Überwachung „Pharmakologisch wirksamer Stoffe“ – ein Beitrag zum gesundheitlichen Verbraucherschutz
Überwachung „Pharmakologisch wirksamer Stoffe“ – ein Beitrag zum gesundheitlichen VerbraucherschutzWirkungen unter KontrollePharmakologisch wirksame Stoffe werden in der landwirtschaftlichen Nutztierhaltung als Bestandteile von Tierarzneimittelpräparaten verwendet und dienen damit der Krankheitsvorbeugung und -bekämpfung. Tierarzneimittelrückstände sind nach gesetzlicher Definition alle Stoffe mit pharmakologischer Wirkung – seien es wirksame Bestandteile, Arzneiträger oder Abbauprodukte – einschließlich ihrer Stoffwechselprodukte, die in Nahrungsmitteln tierischen Ursprungs vorhanden sind und aus der Anwendung des betreffenden Tierarzneimittels resultieren. NRKP
Der Nationale Rückstandskontrollplan, ein Instrument der Bundesländer zur Untersuchung auf Tierarzneimittel direkt beim Erzeuger bzw. im Schlachtbetrieb
Die Kontrolle von Fleisch, Milch, Eiern, Fisch und Honig sowie Blut (Serum) und Tränkwasser auf Rückstände von Tierarzneimitteln und Hormonen erfolgt in Deutschland auf Basis eines Nationalen Rückstandskontrollplans (NRKP). Die Hauptziele des NRKPs sind das Aufdecken illegaler Anwendung von verbotenen bzw. nicht-zugelassenen Stoffen sowie die Kontrolle des gesetzeskonformen Einsatzes von zugelassenen Arzneimitteln. Zusätzlich wird die Belastung mit verschiedenen Umweltkontaminanten (Pestizide, Schwermetalle, Mykotoxine etc.) erfasst (Abb.1).
Abb.1 NRKP für Sachsen
Der Einfuhrüberwachungsplan (EÜP) für Erzeugnisse tierischen Ursprungs aus Nicht-EU-Staaten wird seit 2004 bundeseinheitlich durchgeführt. Er ist ausgerichtet auf die Kontrolle von Lebensmittel liefernden lebenden Tieren und tierischen Erzeugnissen bei der Einfuhr über Deutschland in die Europäische Union. Die Probenahme erfolgt risikobasiert entsprechend dem Risikoansatz der Verordnung (EG) Nr. 882/2004. Es können demnach aus den Daten auch keine allgemeingültigen Schlussfolgerungen über die tatsächliche Belastung der tierischen Erzeugnisse mit unerwünschten Stoffen gezogen werden. Ziel der Überwachung
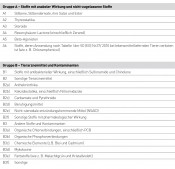
Ziel des NRKPs und des EÜPs ist es, die illegale Anwendung verbotener oder nicht-zugelassener Stoffe aufzudecken und den vorschriftsmäßigen Einsatz von zugelassenen Tierarzneimitteln zu kontrollieren. Außerdem wird die Belastung Der NRKP ist ausgerichtet auf die Kontrolle der Tierbestände, der Schlachtbetriebe und der Betriebe, die das noch unverarbeitete Roherzeugnis erhalten. Dies betrifft insbesondere Betriebe, die Milch, Eier, Honig und Wild verarbeiten. Der NRKP ermöglicht es daher, Tiere und tierische Erzeugnisse von Beginn des Produktionsprozesses an zu überwachen. Durch die Probenahme auf einer frühen Stufe der Produktionskette können Produkte, die mit Rückständen belastet sind, leicht bis zum Ursprungsbetrieb zurückverfolgt werden. Die Probenahme erfolgt zielorientiert. Das bedeutet, dass Kenntnisse über örtliche oder regionale Gegebenheiten berücksichtigt werden oder Hinweisen auf unzulässige oder vorschriftswidrige Tierbehandlungen nachgegangen wird. Der NRKP ist also nicht auf die Erzielung statistisch repräsentativer Daten ausgerichtet. Was wird überwacht? Der NRKP umfasst alle der Lebensmittelgewinnung dienenden lebenden und geschlachteten Tiere sowie Primärerzeugnisse vom Tier. Im Rahmen des NRKPs werden demnach Rinder, Schweine, Schafe und Pferde sowie deren Blut (Serum) und Tränkwasser, Geflügel, Fische aus Aquakulturen sowie Kaninchen, Wild, Eier, Milch und Honig nach den EU-weit geltenden Vorschriften kontrolliert [1]. Untersuchungsspektrum PWS Das Stoffspektrum der Tierarzneimittel und Hormone umfasst nach allgemeinen Vorgaben der EU folgende Gruppen (siehe auch Tab.): // Gruppe A – verbotene Stoffe mit anaboler Wirkung und nicht-zugelassene Stoffe wie Stilbene, Thyreostatika, Steroide, Resorcylsäure-Lactone, Beta-Agonisten, verbotene Antibiotika und Chemotherapeutika. // Gruppe B – Stoffe mit antibakterieller Wirkung, z.B. Penicilline, Sulfonamide, Chinolone, Tetracycline, Makrolide, Aminoglycoside etc. sowie sonstige Tierarzneimittel wie Antiparasitika, Kokzidiostatika einschl. Nitroimidazole, Beruhigungsmittel, entzündungshemmende Mittel, Insektizide und Carbamate [2]. Für die Auswahl der zu untersuchenden Stoffe im Einzelnen ist in erster Linie ihre Relevanz ausschlaggebend. Der NRKP ist kein starres Programm – Erkenntnisse aus den vorangegangenen Beobachtungsperioden sowie Empfehlungen der EU-Kommission und der EU-Referenzlaboratorien werden laufend berücksichtigt.
Tab Stoffgruppen
Untersuchungsstrategie und Analysentechniken Zum Zwecke einer raschen und kostengünstigen Untersuchung werden die Proben, wenn analytisch durchführbar, mittels Screening-Verfahren auf mögliche positive Ergebnisse untersucht. Hemmstoff-Tests auf antibakteriell wirksame Substanzen sowie immunchemische und mikrobiologische Rezeptorverfahren wie ELISA, RIA und Charm-Test sind gebräuchliche Analysentechniken. Zur Bestätigung nicht-negativer Screening-Ergebnisse sowie bei allen Substanzklassen, für die kein geeignetes Screening möglich ist, werden chromatographische Verfahren wie HPLC mit Spezialdetektoren (DAD und FLD), GC-MS und stark zunehmend Tandem-Massenspektrometrie (ESI-LC-MS-MS) angewendet (Abb.2).
Abb.2 Agilent GC-MSD
Die Anforderungen an die Analytik sind sowohl personal- als auch materialaufwändig. Es dürfen prinzipiell nur validierte Untersuchungsmethoden angewendet werden. Die Bestimmung von CC-alpha (Entscheidungsgrenze) und CC-beta für das Nachweisvermögen ist gemäß Entscheidung 2002/657/EG unumgänglich [3]. Aufgrund der großen Bandbreite von Polarität und Molekülmasse der Tierarzneimittel ist die LC-MS-MS die Methode der Wahl. Das Auftreten von Matrixeffekten in diesen anerkannt schwierigen tierischen Matrices stellt eine besondere Herausforderung dar, die durch besonders aufwändige Reinigung oder Verdünnung der Proben positiv beeinflusst werden kann [4,5]. Die Anwendung von sogenannten Multimethoden ist somit bisher nur in eingeschränktem Umfang möglich. Derzeit können etwa 100 Wirkstoffe in einem Analysengang mit Tandem-MS detektiert werden (Abb.3 und 4.) [6,7].
Abb.3 Agilent QQQ 6490
Abb.4 ABSciex API 4000
Im Gegensatz zur Pestizidanalytik, wo mit diversen Multimethoden (QUECHERS) bis zu 300 Wirkstoffe in pflanzlichen Produkten simultan in einem Analysengang quantifiziert werden können, ist dieser Umfang bei Tierarzneimitteln (TAM) derzeit nicht realisierbar. Hier besteht noch Forschungsbedarf für die nahe Zukunft. Ausstattung Pro Bundesland existiert in Deutschland jeweils ein entsprechend spezialisiertes Rückstandslabor. Die Ausstattung in Sachsen besteht aus zwei Agilent-GC-MS-Systemen, die im EI (Elektronenstoss-Ionisation)- bzw. NCI (Negative chemische Ionisation)-Modus betrieben werden sowie zwei LC-MS-MS Systemen (AB Sciex und Agilent), die ca. 80% des Wirkstoffspektrums abdecken. Des Weiteren sorgen noch zwei HPLC-Messplätze mittels hochspezifischer Fluoreszenz-Detektion, gemäß den Vorschriften diverser §64-Methoden, für die Untersuchung spezieller Tierarzneimittel [8]. Ein ELISA-Labor ist auf die schnelle und sehr spezifische Bestimmung von Einzelsubstanzen aus dem Antibiotika-Bereich spezialisiert. Untersuchungen auf Streptomycin in Honig gehören ebenso zum Routinespektrum wie die Untersuchung auf diverse Vitamine, die als Zusätze zu Nahrungsergänzungsmitteln (NEM) in Frage kommen. Jährlicher Untersuchungsumfang Als Basis für die Anzahl der zu untersuchenden Proben dienen nach Vorgaben der EU die jährlichen Schlachtzahlen der vorgenannten Tierarten sowie die Produktionszahlen der Primärerzeugnisse Milch, Eier und Honig in dem jeweiligen Bundesland. Jede Probe wird auf Stoffe aus einer bestimmten Stoffgruppe untersucht, wobei eine freiwillige Untersuchung auf weitere Stoffe aus anderen Stoffgruppen möglich ist. Für Milch, Eier und Honig ist durch eine Entscheidung der EU-Kommission die Untersuchung einer Probe auf mehrere Stoffgruppen vorgegeben. Die Probenahme erfolgt durch qualifiziertes veterinärmedizinisches Personal direkt beim Erzeuger oder im Schlachtbetrieb. Ähnlich wie in der Dopinganalytik werden A- und B-Proben gezogen, amtlich versiegelt und entsprechend den geltenden Vorschriften gekühlt transportiert und aufbewahrt. Die A-Probe wird entsprechend den EU-Vorgaben sowie dem im NRKP festgelegten Untersuchungsumfang einer Prüfung unterzogen. Neben den mehr als 2000 NRKP-Proben werden im gleichen Labor auch noch ca. 800 sogenannte amtliche Lebensmittelproben gemäß § 42 LFGB untersucht. Diese Analysen umfassen nicht nur TAM in den vorgenannten Proben aus dem Handel, sondern auch spezielle Untersuchungen auf pharmakologisch relevante Stoffe wie Morphin in (Back-)Mohn und THC (Tetrahydrocannabinol) in hanfhaltigen Lebensmitteln. Die Bestimmung von Capsaicin in Chilli-Produkten sei hier ebenso erwähnt wie die GC-MS-Analyse von Aromastoffen oder Androstenon, dem sogenannten Ebergeruchsstoff, in Schweinefleisch. Die Untersuchung von Pyrrolizidin-Alkaloiden in Honig und Kräutertees mittels LC-MS-MS befindet sich derzeit in der Validierungsphase. Kooperation Für sogenannte kleine Tierarten wie Wild, Puten, Kaninchen etc. oder für die Untersuchung auf sehr spezielle Wirkstoffe, wie z. B. Beta-Agonisten in speziellen Matrices wie die Retina des Auges, sind oft nur geringe Untersuchungszahlen gefordert. Hier hat sich die Mitteldeutsche Kooperation sehr bewährt. Die drei PWS-Labore in Stendal (Sachsen-Anhalt), Bad-Langensalza (Thüringen) und Chemnitz (Sachsen) halten hier jeweils spezielle, validierte Untersuchungsmethoden für diese Proben aus allen drei Bundesländern vor. Unsachgemäße und missbräuchliche Anwendung von Tierarzneimitteln als Risikofaktoren Bei ordnungsgemäßer Anwendung von Tierarzneimitteln verbleiben in den von behandelten Tieren gewonnenen Lebensmitteln nur Rückstandsmengen, die als toxikologisch unbedenklich gelten. Der unsachgemäße Umgang mit Arzneimitteln, beispielsweise die Nichteinhaltung der erforderlichen Wartezeit nach der Behandlung oder gar die rechtswidrige Applikation verbotener Wirkstoffe, kann indes zu Rückständen führen, die ein gesundheitliches Risiko für den Verbraucher darstellen. Die missbräuchliche Anwendung von Antibiotika birgt ferner die Gefahr der unbeabsichtigten selektiven Heranzüchtung resistenter Krankheitserreger. Antibiotikaresistente pathogene Keime können sich in Tierbeständen verbreiten oder auch auf den Menschen übergehen [9].
Abb.5 Komponentenverteilung einer entwickelten Multi-Detektionsmethode für 215 TAM am LC-MS-MS QQQ 6490 Agilent Technologies
Die Ergebnisse des NRKP können auf der BVL-Homepage eingesehen werden [1]. Im Jahr 2012 wurden in Deutschland 704.960 Untersuchungen an 58.998 Proben von Tieren oder tierischen Erzeugnissen durchgeführt. Insgesamt wurde auf 971 Stoffe geprüft, wobei jede Probe auf bestimmte Stoffe dieser Stoffpalette untersucht wurde. Von den 58.998 Proben waren 268 positiv. Der Prozentsatz der ermittelten positiven Rückstandsbefunde war mit 0,45% im Vergleich zum Vorjahr etwas niedriger. Im Jahr 2011 waren 0,56% und im Jahr 2010 0,73% der untersuchten Planproben mit Rückständen oberhalb der zulässigen Höchstgehalte bzw. mit nicht-zugelassenen oder verbotenen Stoffen belastet. Aussagen zur gesundheitlichen Bewertung der Ergebnisse des NRKPs werden vom Bundesinstitut für Risikobewertung (BfR) veröffentlicht [10]. Die gesundheitliche Beeinträchtigung der Verbraucher durch die im Rahmen des NRKP und des EÜP 2012 gemessenen Rückstände von Stoffen mit anaboler Wirkung und nicht-zugelassenen Stoffen sowie von Stoffen mit antibakterieller Wirkung wird als sehr geringfügig bewertet. Generell kann festgestellt werden, dass die Überschreitung von MRL-Werten (Rückstandshöchstmengen) für TAM in Deutschland deutlich unter der 1,0-%-Marke liegt. Diese Beanstandungsquote ist signifikant kleiner als beispielsweise für Pestizide in Lebensmitteln, die sich zwischen 3–7% bewegt. Auf Europa bezogen ist diese Beanstandungsrate sogar noch deutlich kleiner und liegt laut EFSA-Report 2012 bei nur 0,25%. Einzig die Stoffgruppen B3c und B3e liegen bei den „non-compliant samples“ des EFSA-Reports 2012 mit 2,9 bzw. 1,95% etwas höher. Da es sich bei diesen Verbindungen um Schwermetalle bzw. Farbstoffe handelt, also typische Umweltkontaminanten, ist nicht von einer vorsätzlichen Gefährdung auszugehen [11]. Fazit Die veterinärmedizinische Anwendung/Verordnung erfolgt in aller Regel sachgerecht und die vorgeschriebenen Wartefristen werden eingehalten. Damit ist sichergestellt, dass die Bevölkerung sehr gut vor möglichen toxikologischen Risiken geschützt ist. Problematisch bleiben weiterhin die viel zu hohen Abgabemengen an TAM im Rahmen der veterinärmedizinischen Versorgung. Auch die dritte Datenerhebung zur Antibiotikaabgabe in der Tiermedizin weist für das Jahr 2013 noch eine Abgabemenge von 1.452 Tonnen auf [12]. Dies sind 167 Tonnen weniger als im Vorjahr und gegenüber der ersten Erfassung im Jahr 2011 ein Minus von rund 250 Tonnen. Die Menge an Fluorchinolonen, deren Verwendung in der Tiermedizin wegen ihrer wichtigen Bedeutung für die Verwendung als Reserveantibiotikum in der Humanmedizin kritisch gesehen wird, ist gegenüber der Vorjahresmeldung leider um drei Tonnen und im Vergleich zu der Menge 2011 sogar um fünf Tonnen angestiegen. Deshalb erwägt Niedersachsen ein Verbot dieser sogenannten Reserveantibiotika für den veterinärmedizinischen Einsatz [13]. Hier ist die Politik gefordert, regulierend im Sinne eines vorbeugenden gesundheitlichen Verbraucherschutzes einzugreifen. Literatur
[1] BVL Amtliche Lebensmittelüberwachung NRKP und EÜP Bild: © istockphoto.com| Roberto A Sanchez |
L&M 7 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |