|
Bio&Biotech
 >
Untersuchungen zur Wechselwirkungen von Infrarot- und Röntgenstrahlung
>
Untersuchungen zur Wechselwirkungen von Infrarot- und Röntgenstrahlung
Untersuchungen zur Wechselwirkungen von Infrarot- und RöntgenstrahlungIm „Rotlichtviertel“ der TU DarmstadtInfrarot- und Röntgenstrahlung repräsentieren Strahlungen von den entgegengesetzten Seiten des elektromagnetischen Spektrums. Beide werden in der Medizin genutzt, wobei den positiven Effekten von Infrarotstrahlung die schädigende Wirkung von Röntgenstrahlung auf menschliche Zellen diametral gegenübersteht. Die Kombination dieser beiden Strahlungen in einer Therapie könnte in Zukunft Krebstherapien wirkungsvoller gestalten. Infrarotstrahlung ist ein ständiger Begleiter des Menschen. Fast 50% der Sonnenstrahlung, welche auf die Erdoberfläche gelangt, gehört dem Infrarotspektrum an und vermittelt dort einen für den Menschen unverzichtbaren Effekt: Wärme. Dieser Effekt beruht auf der starken Absorption der Infrarotstrahlung durch Wassermoleküle, nicht nur in der Atmosphäre, sondern auch auf der Körperoberfläche des Menschen. Medizinisch hat der Mensch sich die Erwärmung des Körpers bereits seit dem Altertum zu Nutze gemacht und findet auch in der heutigen Schulmedizin in Form von Bestrahlungen mit Infrarotlampen weiterhin Verwendung. Ausnahmen von der Regel Die Wechselwirkung von Infrarotstrahlung mit Wasser ist jedoch nicht so einfach, wie man zunächst annehmen möchte. Einige Wellenlängen des kurzwelligen Infrarotbereichs, genauer gesagt, des Infrarot A-Bereichs, der Teil der so genannten nahen Infrarotstrahlung ist, werden von Wassermolekülen kaum absorbiert (siehe Abb. 1). Da es auch in der menschlichen Haut kaum Absorber für diese Wellenlängen gibt, ist dieser Strahlungsbereich in der Lage, vergleichsweise tief in menschliches Gewebe einzudringen. Dort kann die Strahlung durch die Interaktion mit der Cytochrom-C-Oxidase, einem Molekül der Atmungskette in den Mitochondrien, den Metabolismus der Zellen stimulieren [1]. Auch diesen Effekt machen sich Mediziner inzwischen zu Nutze: Wird das Infrarotlicht mit einem Wasserfilter appliziert, so wird eine schmerzhafte und schädliche Überhitzung des oberflächlichen Gewebes auch bei vergleichsweise hohen Infrarotdosen vermieden. Stattdessen kommt es zur Erwärmung des Gewebes von innen heraus.
Abb.1 Vergleich der Spektren eines Strahlers für wassergefiltertes Infrarot A (wIRA) und der Sonne. Beide Spektren zeigen die Verminderung der Bestrahlungsstärke durch die in diesem Bereich erhöhte Absorption durch Wasser. Der Filtereffekt der in der Atmosphäre auf Wasserdampf zurückzuführen ist, wird beim wIRA-Strahler durch den Einsatz eines Wasserfilters hervorgerufen und ermöglicht eine Bestrahlung der Patienten mit hohen Dosen ohne schmerzhafte Erwärmung des Gewebes.
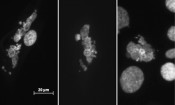
Wassergefiltertes Infrarot A in Medizin & Forschung Der Anwendungsbereich dieser tief gehenden Wärmebehandlung mit wassergefilterter Infrarot-A-Strahlung (wIRA) in der Medizin ist erstaunlich breit gefächert [2]. Neben der Beschleunigung von Wundheilungen, kann sie außerdem zur Minderung von Schmerzen und Entzündungen beitragen. Selbst zur Vorsorge gegen postoperative Infektionen kann wIRA verwendet werden. Ein noch junges Feld in der medizinischen Anwendung von wIRA stellt dessen Einsatz in der Radiotherapie dar. Dabei werden die Tumore von Krebspatienten mit hochenergetischer, so genannter ionisierender Strahlung (z.B. Röntgenstrahlung) behandelt, wodurch deren genetisches Material, die DNA, im Idealfall so stark geschädigt wird, dass es zum Absterben der Krebszellen kommt. Seit Langem ist bekannt, dass eine lokale Erwärmung von Tumoren (Hyperthermie) die radiotherapeutische Behandlung zur Krebszellschädigung unterstützen kann [3]. Der Einsatz von wIRA-Strahlern stellt hierbei eine neue Möglichkeit dar, selbst tiefer liegende Tumore zu erwärmen und sie so für die nachfolgenden Behandlungen mit Zytostatika oder Röntgenstrahlung zu sensibilisieren. Erste Ergebnisse solcher Behandlungen sind viel versprechend und wecken die Hoffnung auf eine weitere Verbreitung dieser Therapieform. Wärme- oder alleiniger Infraroteffekt Eine weitere Verbreitung dieser wIRA-Methoden ist jedoch erst dann realisierbar, wenn die Wirkungsweise einer solchen Behandlung näher geklärt ist. Im Falle der wIRA-Bestrahlung ist bislang unklar, inwieweit die positiven Effekte lediglich auf die induzierte Hyperthermie oder aber auch auf direkte Effekte der Infrarotstrahlung auf zelluläre Komponenten zurückzuführen sind. Um diese Frage zu klären, wird an der TU Darmstadt untersucht, inwieweit wassergefilterte Infrarot-A-Strahlung in An- und Abwesenheit von hyperthermischen Bedingungen die Reaktion von menschlichen Zellen auf eine Behandlung mit Röntgenstrahlung beeinflusst. Tatsächlich ist die Datenlage für diese Form von Untersuchungen beeindruckend dünn. Trotz der alltäglichen Exposition von Menschen mit Infrarot und stetig wachsenden Zahlen an Krebspatienten, die Radiotherapien unterzogen werden, wurden die letzten Studien über mögliche Interaktionen zwischen naher Infrarot- und ionisierender Strahlung in den 50er-Jahren des letzten Jahrhunderts durchgeführt [4]. Um diese Wissenslücken zu schließen, werden in Darmstadt nun humane Zelllinien mit Infrarotstrahlung, Hyperthermie oder einer Kombination aus beidem behandelt und anschließend mit therapierelevanten Röntgendosen bestrahlt. Die entscheidende Herausforderung hierbei war die Konstruktion einer geeigneten Bestrahlungsapparatur, für die es einiger Ingenieurskunst bedurfte. Inzwischen kann in Darmstadt jedoch dank finanzieller Unterstützung durch die Dr. h.c. Erwin Braun-Stiftung auf bereits klinisch angewandte wIRA-Strahler zurückgegriffen werden. Da bei einer solchen Therapie neben dem behandelten Tumor auch stets gesundes Gewebe bestrahlt wird, werden bei den Untersuchungen sowohl Zellen aus gesundem Gewebe, sowie aus Tumoren isolierte Zellen verwendet. Dadurch können Rückschlüsse auf mögliche Unterschiede in der Reaktion auf die Behandlung in gesundem und erkranktem Gewebe gezogen werden. Infrarot als direkt wirkendes Agens Das wichtigste Fazit der bislang durchgeführten Studien ist bislang, dass Infrarot A auch ohne Temperaturerhöhung durchaus in der Lage ist, die Reaktion der Zellen auf Röntgenbestrahlung grundlegend zu verändern [5]. Der erste Hinweis darauf ergab sich bei der genauen Betrachtung der Zellkerne in den unterschiedlich behandelten Zellen. Erfolgt vor der Röntgenbestrahlung eine Behandlung mit Infrarot, zeigen sich danach gegenüber der alleinigen Röntgenbestrahlung stets mehr Zellen mit entarteter Zellkernmorphologie (siehe Abb. 2). Dabei handelt es sich um so genannte mitotische Katastrophen, die aus einer fehlerhaften Aufteilung der DNA bei der Zellteilung auf die beiden Tochterzellen hervorgehen. Diese Zellen sind i.d.R. nicht mehr teilungsfähig. Im Hinblick auf Krebszellen würde eine Erhöhung der Anzahl der mitotischen Katastrophen also eine effektivere Behandlung bedeuten. Dies gilt jedoch nur, solange diese Zellen tatsächlich keine Teilungen mehr vollziehen. Somit sind endgültige Aussagen im Hinblick auf den Nutzen bzw. das Risiko einer vorherigen Infrarotbehandlung momentan noch nicht möglich. Es ist jedoch wichtig zu betonen, dass der hier geschilderte Einfluss von Infrarot auf die genetische Stabilität humaner Zellen lediglich in Kombination mit Röntgenstrahlung auftritt. Alleinige Infrarotstrahlung hat dagegen keine derart schädlichen Auswirkungen.
Abb.2 Mitotische Katastrophen sind polynukleäre Zellen, die bei fehlerhaften Mitosen entstehen können. Bei der mitotischen Katastrophe handelt es sich um viable, aneuploide Zellen, die sich i.d.R. nicht mehr teilen. Ihr Anteil an der gesamten Zellpopulation wird durch eine Vorbehandlung mit athermischem, nahem Infrarot vor der Röntgenbestrahlung erhöht. Der Weg in die Katastrophe Auf der Suche nach den Mechanismen, mit deren Hilfe Infrarot die Reaktion der Zellen auf die Röntgenbestrahlung verändert, zeigte sich eine erstaunlich breite Wirkungsweise der Infrarotstrahlung. Für eine fehlerfreie Weitergabe ihrer DNA auf die entstehenden Tochterzellen müssen die Zellen vor ihrer Teilung ständig die Integrität ihres Genoms überprüfen. Auftretende Schädigungen der DNA, wie sie z.B. durch ionisierende Röntgenstrahlung hervorgerufen werden, können Zellen mithilfe verschiedener Reparaturwege beseitigen. Die Reparatur muss jedoch noch vor der Teilung bzw. der dafür notwendigen Replikation der DNA erfolgen, wofür die Zellen so genannte Zellzyklus-Checkpoints entwickelt haben. Mit ihrer Hilfe kann der Zellzyklus arretiert und somit auch die Zellteilung unterdrückt werden. Erst wenn die Schäden ausreichend repariert sind, wird der Zellzyklus fortgesetzt [6]. Die Forschungen an der TUD haben gezeigt, dass Vorbehandlungen der Zellen mit Infrarot dazu führen, dass sich die Reparatur der Röntgen-induzierten DNA-Schäden verringert. Gleichzeitig wird jedoch der Zellzyklusarrest früher aufgehoben, als es nach alleiniger Röntgenbestrahlung der Fall ist. Die Zellen beginnen somit früher mit der Verdopplung ihrer DNA, obwohl diese noch mehr Schäden aufweist als die der nur röntgenbestrahlten Zellen. Somit erhöht sich die Wahrscheinlichkeit der Weitergabe genomischer Fehler auf die entstehenden Tochterzellen. Kraftwerke der Zelle als das Ziel von Infrarot Als ein möglicher Grund für das veränderte Checkpoint-Verhalten der infrarotvorbehandelten Zellen konnte ein verändertes Niveau von reaktiven Sauerstoffspezies (ROS) nach der Röntgenbestrahlung ausgemacht werden. Diese hochreaktiven sauerstoffhaltigen Radikale sind in der Lage, zelluläre Bestandteile wie Proteine und Lipide durch deren Oxidation zu schädigen. Gleichzeitig können sie jedoch auch den Fortgang der Zelle durch den Zellzyklus regulieren. Werden Zellen einer Röntgenbestrahlung ausgesetzt, so kommt es innerhalb der Zellen durch die Spaltung von Wassermolekülen zu einem drastischen Anstieg des ROS-Levels. Eine Infrarotvorbehandlung führt zu einem noch stärkeren Anstieg, wobei dieser signifikante Effekt – ähnlich dem Einfluss auf die genomische Stabilität – lediglich nach einer Kombination von nahem Infrarot mit Röntgen, nicht aber nach alleiniger Infrarotbehandlung auftritt. Eine mögliche Ursache hierfür könnte in einer Zunahme der mitochondrialen Masse in den infrarotvorbehandelten Zellen liegen, wie wir sie tatsächlich nachweisen konnten. Die Mitochondrien sind die Kraftwerke der Zelle, die für die Energieversorgung verantwortlich sind und beinhalten mit der Cytochrom-C-Oxidase den wichtigsten, bislang identifizierten Akzeptor für nahe Infrarotstrahlung [7]. Veränderungen in der mitochondrialen Masse humaner Zellen konnten auch in anderen Studien bereits als Ursache für die Zunahme genomischer Instabilität nach Röntgenbestrahlung identifiziert werden [8]. Die bisherigen Ergebnisse unserer Studien aus Darmstadt zeigen also einen signifikanten Einfluss einer Behandlung mit wassergefilterter, naher Infrarotstrahlung auf die Effekte von ionisierender Strahlung in humanen Zellen, die eben nicht auf Hyperthermie zurückzuführen sind. Die zukünftige Aufgabe wird es nun sein, den zusätzlichen Einfluss von Hyperthermie zu untersuchen, um eine weitere Verbreitung von wIRA-Behandlungen als eine unterstützende Methode der Radiotherapie zu ermöglichen.
Literatur Foto: © Fotolia.com | vschlichting |
L&M 7 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |