|
L&M-3-2015
>
Auf der Suche nach Qualitätskriterien für ein erfolgreiches Spermium
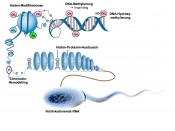
Auf der Suche nach Qualitätskriterien für ein erfolgreiches SpermiumWas zeichnet einen Winner-Typ aus?Weltweit ist etwa eines von sechs Paaren ungewollt kinderlos, wobei der männliche Partner in etwa der Hälfte der Fälle ursächlich beteiligt ist. Da in diesen Fällen die Frau für ein Problem ihres Partners behandelt werden muss, besteht eine dringende Notwendigkeit für einen Biomarker, mit dessen Hilfe die Erfolgsaussicht einer assistierten Reproduktion besser abgeschätzt werden könnte. Dieser Aufgabe stellt sich die Arbeitsgruppe von Klaus Steger. Wer kennt es nicht: Das Bild mit den beiden friedlich nebeneinandersitzenden Avy (Agouti-viable-yellow) Mäusen – die eine mit braunem Fell ist kerngesund, die andere mit orangefarbenem Fell erscheint riesig, fett und besitzt eine Prädisposition für Diabetes und Krebs [1]. Der einzige Unterschied dieser beiden genetisch vollkommen identischen Mäuse besteht darin, dass die Mutter der gesunden Maus während der Tragzeit zusätzlich zum normalen Futter noch B-Vitamine verabreicht bekam. Diese liefern dem Körper Methylgruppen, die an sogenannte CpG-Inseln in der Promotorregion des Agouti-Gens binden und das Gen abschalten können. 15 Jahre später konnte gezeigt werden, dass eine folatdefiziente Ernährung männlicher Mäuse nicht nur Auswirkungen auf das Spermienepigenom hat, sondern darüber hinaus auch noch zu einer verringerten Nachkommenzahl und einer erhöhten Missbildungsrate führt [2]. Inzwischen gilt als gesichert, dass das Spermium bei der Befruchtung der Eizelle nicht nur sein haploides Genom, sondern zusätzlich auch noch epigenetische Markierungen überträgt, denen eine wichtige Rolle beim Start der Genexpression und bei der frühen Embryonalentwicklung zukommt. Interessanterweise konnten in Spermien nicht nur alle auch in somatischen Zellen bekannten epigenetischen Mechanismen nachgewiesen werden, es konnten darüber hinaus sogar noch spermienspezifische Prozesse identifiziert werden. Dies könnte unserer Meinung nach daran liegen, dass durch die Kondensation des Kernchromatins in testikulären Spermatiden keine Transkription mehr möglich ist, nach der Befruchtung aber zunächst das Spermiengenom aktiviert wird. Die epigenetischen Markierungen am Spermienepigenom könnten somit eine Art „Gebrauchsanweisung“ darstellen, die der Eizelle mitteilt, wie sie mit dem für sie ja fremden Spermiengenom umzugehen hat; man denke in diesem Zusammenhang z.B. an die Gene mit väterlichem Imprinting (siehe weiter unten). Epigenetische Marker koordinieren die Expression unserer Gene Jeder von uns ist aus etwa 70 Billionen Zellen aufgebaut, wobei sich im Kern einer jeden Zelle unsere gesamte Erbinformation befindet. Diese setzt sich aus Genen zusammen, die in verschlüsselter Form die Bauanleitung für die Bausteine unseres Körpers (Proteine) enthalten. Eine der großen Überraschungen des humanen Genomprojekts war, dass unsere Gene nur etwa 10% der Speicherkapazität unseres Erbmaterials belegen. Der weitaus größte Teil, ehemals abwertend als Genschrott bezeichnet, wird für die Regulation benötigt. Im Nachhinein erscheint dies logisch, da eine Muskelzelle andere Proteine (und somit andere aktive Gene) benötigt als eine Darmzelle und selbst ein und dieselbe Leberzelle im Tagesverlauf unterschiedliche Anforderungen an ihre Enzymausstattung hat, je nachdem, ob wir gerade eine Pizza verspeist oder bei einer Geburtstagsfeier einen über den Durst getrunken haben. Inzwischen ist klar, dass es insbesondere die epigenetischen Markierungen innerhalb der Regulationssequenzen unserer DNA sind, die darüber entscheiden, welche Gene in einer bestimmten Zelle zu einer bestimmten Zeit abgelesen werden und welche nicht. Diese Markierungen sind unabhängig von der DNA-Sequenz, umkehrbar und (mindestens über zwei Generationen) vererbbar. Die aktuell bekannten epigenetischen Mechanismen umfassen die Methylierung der DNA, die Modifizierung von Histonen sowie die Regulation durch nichtcodierende kleine RNA-Moleküle und Chromatin-Remodellern (Abb.1).
Abb.1
Spermienspezifische epigenetische Prozesse Die Methylierung der DNA erfolgt ausschließlich an der Base Cytosin und auch nur dann, wenn dieser ein Guanin (5´--> 3´-Richtung) folgt (sogenannte CpG-Inseln). Insbesondere bei Keimzellen kommt dem genetischen Imprinting, also der elternspezifischen Vererbung, eine wesentliche Bedeutung zu. Denn während im Normalfall der Zufall darüber entscheidet, ob in einer Körperzelle das väterliche oder das mütterliche Allel abgelesen wird, ist dies bei den ca. 100 bekannten Imprinting-Genen geschlechtsspezifisch festgelegt. So weisen Samenzelle und Eizelle ein unterschiedliches Imprintingmuster auf. Nach ihrer Verschmelzung zur Zygote müssen zunächst alle Markierungen gelöscht werden, um dann im Anschluss daran das geschlechtsspezifische Muster für Jungen oder Mädchen auszubilden. Es ist bekannt [Metaanalyse in 4], dass durch intrazytoplasmatische Spermieninjektion (ICSI) gezeugte Kinder ein leicht erhöhtes Risiko für das Auftreten des Beckwith-Wiedemann-Syndroms besitzen, das auf einer veränderten Methylierung der IgF2/H19-Region des väterlichen Allels zurückzuführen ist. Interessant ist, dass Spermien neben einer Methylierung auch eine Hydroxymethylierung aufweisen, deren Funktion noch nicht vollständig geklärt ist. Weit komplexer und daher weniger gut erforscht als die DNA-Methylierung ist die Modifizierung von Histonen. Diese können acetyliert, methyliert, phosphoryliert oder auch ubiquitiniert sein. Während die Acetylierung von Lysinresten stets mit einer Aktivierung der assoziierten Gene verbunden ist, können bis zu drei Methylgruppen an Lysin- und Argininresten angebracht werden und, je nach Ort und Anzahl, aktivierend oder inhibierend auf die assoziierten Gene wirken. In Spermien kommt als Besonderheit hinzu, dass die Mehrzahl der Histone durch Protamine (siehe weiter unten) ersetzt wird, sodass nur noch ca. 1–10% (je nach Spezies) des Chromatins in Form von Nukleosomen vorliegen. Überraschenderweise tragen die Resthistone eine Vielzahl an epigenetischen, auch aktivierenden Markierungen, obwohl bekannt ist, dass Spermien transkriptional inaktive Zellen sind. Daraus resultierte die Hypothese, dass die epigenetischen Markierungen zusammen mit dem haploiden Genom bei der Befruchtung vom Spermium auf die Eizelle übertragen werden und dort eine wichtige Rolle bei der frühen Embryonalentwicklung spielen. So traten bestimmte Histonmodifikationen bevorzugt an Genen auf, denen eine Rolle bei der Embryonalentwicklung zugesprochen wird, wie Imprinting-Gene, HOX-Gene oder microRNA-Cluster. Andererseits gibt es auch Hinweise, dass die Nukleosomen relativ gleichmäßig über das Genom verteilt sind (Abb.2) [Übersicht in 5].
Abb.2
Sind Protamine der Schlüssel zum Sieg? Bei einem Standard-Spermiogramm werden routinemäßig Konzentration, Morphologie und Beweglichkeit der Samenzellen bestimmt. Diese Parameter stellen jedoch keine verlässlichen Biomarker für den Erfolg einer Befruchtung dar, insbesondere wenn Techniken der assistierten Reproduktion (ART) zur Anwendung kommen. Da speziell bei der intrazytoplasmatischen Spermieninjektion (ICSI) die natürlichen Barrieren der Spermienselektion umgangen werden, erscheint die Integrität des Spermienchromatins am geeignetsten, um die Spermienqualität und somit die Befruchtungswahrscheinlichkeit einer Eizelle zu prognostizieren. Die Arbeitsgruppe von Klaus Steger beschäftigt sich seit über 15 Jahren mit dem Histon-Protamin-Austausch während der männlichen Keimzellentwicklung. Hierbei werden die somatischen Histone zunächst gegen hodenspezifische Varianten ausgetauscht. Anschließend lagern sich noch Transitionsproteine an. In den haploiden Spermatiden wird schließlich der Großteil der Histone sowie die Transitionsproteine durch Protamine ersetzt (Abb.3). Diese binden an die DNA und leiten die Kondensation des Chromatins ein, die letztlich zu einem kompletten Stopp der Transkription führt. Dies hat zur Folge, dass Spermatiden im Hoden und Spermien im Ejakulat eine identische mRNA-Ausstattung aufweisen. Eine molekularbiologische Analyse des Ejakulats erlaubt somit Rückschlüsse auf die Spermatogenese, während die Analyse einer Hodenbiopsie Vorhersagen über die Spermienqualität ermöglicht. Mittels Polymerasekettenreaktion (PCR) können sowohl frische als auch tiefgefrorene Hodengewebsproben [6] und Samenproben [7] untersucht werden. Da für eine Untersuchung nur minimale Mengen des kostbaren Patientenmaterials benötigt werden, eignet sich diese Methode auch für den Einsatz in der Klinik. Die Studien von Klaus Steger zeigen, dass insbesondere dem Verhältnis von Protamin-1 zu Protamin-2, der Protaminratio, eine entscheidende Bedeutung für die Spermienqualität zukommt, denn so weisen subfertile Patienten im Vergleich zu fertilen Männern eine signifikant veränderte Protaminratio auf [6, 7]. Der funktionelle Beweis wurde bereits zuvor an Protamin-1 und -2-defizienten Mäusen erbracht [8].
Abb.3
Ausblick Um die Aussagekraft der Protaminratio weiter zu verbessern, möchte Klaus Steger die Ergebnisse demnächst mit Daten zur DNA-Fragmentation, einem weiteren Parameter zur Spermienqualität, kombinieren. Für einen geplanten Schnelltest erhielt er 2014 ein Patent. Der Epigenetik schreibt er eine zentrale Rolle zu – insbesondere auch nach erfolgter Befruchtung. Sie könnte in Zukunft eine Erklärung dafür liefern, warum immer wieder erfolgreich befruchtete Keime die Teilung einstellen und absterben. Ein Problem wird sich jedoch auch in absehbarer Zeit nicht lösen lassen. So liefert jeder Test ausschließlich Informationen zum männlichen Partner. Es ist aber bekannt, dass qualitativ schlechte Spermien, wenn sie auf eine Eizelle mit guter Qualität treffen, durchaus zu einer Befruchtung führen können. Umgekehrt kann die Kombination eines hochfertilen Spermiums mit einer Eizelle von sehr schlechter Qualität nicht zum gewünschten Erfolg führen. Jeder Spermientest wird also nur einen Puzzlestein liefern, den der behandelnde Arzt – zusammen mit den weiblichen Faktoren – zu einem Gesamtbild zusammenfügen muss. Für eine erfolgreiche Befruchtung spielen also Spermium und Eizelle gleichermaßen eine wichtige Rolle – ähnlich wie bei einem Formel 1 Sieg, der sowohl vom Können des Fahrers als auch von der Qualität des Fahrzeugs abhängt.
Literatur Erklärung zum Interessenkonflikt: Seit ca. zwei Jahren bietet Herr Prof. Stegers Labor die Bestimmung der Protaminratio für Arztpraxen und IVF-Zentren an (FertiCert®). Bild: © istockphoto.com|Tarchyshnik |
L&M 3 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |