|
Wie die Vitaminanalytik in die Platte kam
Wie die Vitaminanalytik in die Platte kam
Mikrobiologische Analyseverfahren zur Bestimmung von Vitaminen sind seit Jahrzehnten erprobt und bi s heute in der Lebensmittelanalytik unverzichtbar. Tatsächlich stammen die ersten Berichte über den Einsatz von Bakterien in der Vitaminanalyse aus den späten 1930er Jahren. Lange Zeit wurden die aufwendigen mikrobiologischen Methoden jedoch nur von wenigen spezialisierten Laboratorien durchgeführt. Neuer Schwung kam erst in jüngerer Zeit in die altbewährte Analytik – durch ein innovatives Patent und die Übertragung auf die Mikrotiterplatte.
Wer in der ersten Hälfte des vergangenen Jahrhunderts den Vitamingehalt eines Lebensmittels bestimmen wollte, brauchte Geduld und Versuchstiere. Mangels analytischer Alternativen waren aufwändige Experimente die Regel, bei denen z. B. Ratten, Hunden oder Hühnerküken bekannte (über Standards) bzw. unbekannte (über die zu untersuchende Probe) Mengen eines Vitamins verabreicht wurden und sich der gesuchte Vitamingehalt durch Beobachtung der Tiere über einen längeren Zeitraum ermitteln ließ. So wurde von der an der Gewichtszunahme messbaren Wachstumsrate von jungen Versuchstieren oder solchen, denen zuvor ein bestimmtes Vitamin entzogen worden war, auf den Gehalt in der unbekannten Probe geschlossen [1].
Der Ratte Freud, des Lactobazillus Leid
Es ließen sich noch weitere Versuchsansätze aufzählen, doch nicht zuletzt aus ethischen Gesichtspunkten waren die Tierversuche ab Mitte der 1950er-Jahre nicht mehr zeitgemäß. Neue Methoden mussten her, bevorzugt weniger aufwändig und moralisch vertretbarer. So rückten Mikroorganismen in den Mittelpunkt der Vitaminforschung. Vorreiter auf diesem Gebiet war Lactobacillus casei, dessen Eignung für die Bestimmung von Vitamin B3 (Niacin) bereits 1939 publiziert worden war [2]. Neben weiteren Lactobazillen fanden auch Streptokokken, Hefen und andere Mikroben zunehmend Verwendung in der Lebensmittelanalytik, wodurch das gesamte Spektrum der acht wasserlöslichen B-Vitamine von B1 (Thiamin) bis B12 (Cyanocobalamin) abgedeckt wurde. Einzig für die fettlöslichen Vitamine A, D, E und K ist das mikro-biologische Verfahren ungeeignet. Das Grundprinzip ist schnell erklärt: Bestimmte Mikroorganismen vermehren sich nur in Anwesenheit eines für sie essenziellen Vitamins. Überführt man sie in ein vitamindefizientes Nährmedium, also eines, dem dieses Vitamin fehlt, unterbleibt ihr Wachstum – zumindest so lange, bis der Extrakt der zu untersuchenden Probe hinzugefügt wird. Enthält diese das entsprechende Vitamin, beginnen die Keime zu wachsen. Der Grad des beobachteten Wachstums ist abhängig vom Vitamingehalt der Probe, der sich bei paralleler Durchführung des Versuchs mit einem Standard in bekannten Konzentrationsstufen anhand einer Kalibrierung bestimmen lässt.
Eine Methode nur für Speziallabore?
Was in der Theorie einfach klingt, hat in der Praxis durchaus seine Tücken. Die traditionelle Methode verlangt vom untersuchenden Labor eine hohe mikrobiologische Expertise, genaues und steriles Arbeiten und – auch hier wieder – Geduld. Ausgangspunkt sind definierte Kolonien der benötigten Mikroorganismen, die zunächst kultiviert werden und deren Vitalität durch regelmäßige Überimpfung in frisches Optimalmedium aufrechterhalten werden muss. Bevor mit dem eigentlichen Vitamintest überhaupt begonnen werden kann, muss eine frische Kultur hergestellt und auf eine feste Keimzahl eingestellt werden. Erst dann kann der Organismus in das entsprechende Mangelmedium überimpft werden. Dieses Medium wird im Anschluss mit dem Probenextrakt bzw. dem Vitaminstandard versetzt und im Brutschrank inkubiert. Schließlich wird das Wachstum bzw. der Stoffwechselumsatz gemessen. Dabei bieten sich verschiedene Messgrößen an. Die Vermehrung der Mikroben lässt sich z. B. titrimetrisch, gravimetrisch, nephelometrisch oder turbidimetrisch ermitteln [3].
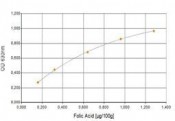
Bei jedem Versuch muss eine parallele, nur für diesen Ansatz gültige Standardkurve angefertigt werden. Der unbekannte Vitamingehalt der Probe wird dann durch Vergleich mit den bekannten Vitamingehalten der Standardreihe ermittelt. Dabei ist die Probe in mehreren Verdünnungen anzusetzen, um zu gewährleisten, dass am Ende der Inkubationszeit mindestens ein Wachstumsmesswert in den Messbereich der Standardkurve fällt. Zudem ist aus Sicherheits- und Genauigkeitsgründen jede Konzentrationsstufe der Standard- und der Probenreihe mindestens zwei- bis dreifach anzusetzen.
Da die Keimsuspension für die Beimpfung der Standard- und Probenreihe nicht lagerfähig ist und für jeden Versuch neu kultiviert werden muss, besteht bei jedem Wachstumsansatz die Unsicherheit, ob die Impfsuspension richtig angezüchtet wurde bzw. der Keim die gewünschte Sensitivität hat.
Dass steriles Arbeiten bei dieser Verfahrensweise ausschlaggebend für den Erfolg der Analyse ist, liegt auf der Hand. Um zu verhindern, dass mühsam herangezüchtete Suspensionen wegen Kontaminationen durch Fremdkeime wieder verworfen und die Versuche von vorn begonnen werden müssen, sind für die Durchführung der traditionellen Methode eine sterile Arbeitsbank und ein Autoklav zum Sterilisieren von Glasröhrchen und Nährmedien unverzichtbar. Die klassische mikrobiologische Bestimmung von Vitaminen ist somit sehr arbeits-
und zeitaufwändig und bedarf einer entsprechenden Laborausstattung und -organisation. Nur sehr wenige Labore im Lebensmittelbereich haben sich auf diese Art der Analytik spezialisiert. Nichtsdestotrotz: Auch wenn sich inzwischen flüssigchromatografische Methoden für die Bestimmung von Vitaminen etabliert haben, die auch eine Differenzierung zwischen verschiedenen Vitameren, Konjugaten und Provitaminen ermöglichen, sind insbesondere bei den oft nur im Mikrogrammbereich nachweisbaren Vitaminen B7 (Biotin), B9 (Folsäure) und B12 (Cyanocobalamin) die mikrobiologischen Assays dank ihrer überlegenen Sensitivität bis heute der Goldstandard [3].
Der patentierte Dornröschenschlaf: VitaFast®
In Zeiten, in denen das 96-Well-Format von ELISA, PCR etc. zum Laboralltag gehört, lag die Frage nahe, ob ein Bioassay, der trotz der Herausforderungen, die er an ein Labor stellt, seit Jahrzehnten Bestand hat, nicht auch ein zeitgemäßes Mikrotiterplattenformat verdient hätte. Obwohl hierzu bereits 1986 erste Versuche publiziert wurden [4], blieb die für ein Routinelabor interessanteste Frage bis ins neue Jahrtausend offen:
Konnte man die mikrobiologische Methode nicht soweit vereinfachen, dass sie in Form eines standardisierten und vor allem lagerfähigen Kitformats kommerzialisierbar wäre?
Den Schlüssel zum Erfolg hielt die Naturselbst bereit. Es ist bekannt, dass sich Bakterien mit einer speziellen glasartigen Schutzschicht überziehen und auf diese Weise vor der Austrocknung auch in Extremlebensräumen wie der Wüste geschützt sind. So können sie in einer Art „Dornröschenschlaf“ lange Trockenperioden überstehen, um bei Besserung der Umgebungsbedingungen sofort wieder aufzuleben. Nach diesem Vorbild gelang es dem ifp Institut für Produktqualität mittels eines speziellen Trocknungsverfahrens, genau definierte Mengen von Bakterien oder Hefen in den einzelnen Kavitäten einer Mikrotiterplatte zu trocknen und lagerfähig zu machen. Das Resultat sind Mikroorganismen, die auch nach einer Lagerzeit von bis zu einem Jahr einfach aus dem Kühlschrank genommen und unmittelbar ready-to-use für die Analyse eingesetzt werden können. Komplettiert wird das Testkit durch alle weiteren für die Durchführung der Analyse benötigten Reagenzien und Materialien:
- 3 x das jeweilige Assay-Medium (lyophilisiert)
- 3 x den entsprechenden Vitaminstandard (lyophilisiert)
- 3 x doppelt destilliertes, steriles Wasser (zum Lösen von Medium /Standard und zum Verdünnen der Probenextrakte)
- 3 x Klebefolie (zum Abkleben der Kavitäten während der Inkubation)
- 1 x Halterahmen für die einzelnen 8er-Streifen der Mikrotiterplatte
Die unter dem Namen VitaFast®, exklusiv von der R-Biopharm AG vermarktete Produktlinie, umfasst alle wasserlöslichen B-Vitamine:
- Vitamin B1 (Thiamin)
- Vitamin B2 (Riboflavin)
- Vitamin B3 (Niacin)
- Vitamin B5 (Pantothensäure)
- Vitamin B6 (Pyridoxin)
- Vitamin B7 (Biotin)
- Vitamin B9 (Folsäure)
- Vitamin B12 (Cyanocobalamin)
Darüber hinaus sind Testkits für Inositol sowie die Aminosäuren Cystin, Lysin und Methionin erhältlich.
In wenigen Schritten zum Ergebnis
Die Testdurchführung selbst besteht aus wenigen Schritten und lässt sich im Wesentlichen wie folgt zusammenfassen:
- Probenaufarbeitung und Verdünnen der Probenextrakte
- Lösen und Verdünnen des Standards für die Kalibrierung
- Lösen und Sterilfiltrieren des Mediums
- Vorlegen von je 150 l des Mediums in die benötigten Kavitäten der Mikrotiterplatte
- Zugabe von je 150 l des jeweiligen Standards bzw. Probenextraktes
- Versiegeln der Kavitäten mit der Klebefolie
- Inkubation im Brutschrank (bei den meisten Kits 44-48 h bei 37 °C)
- Messung im Mikrotiterplattenrea der bei 610-630 nm, Softwareauswertung
Die traditionell aufwändige mikrobiologische Methode, wie sie weiter oben beschrieben wurde, wurde durch die Miniaturisierung im Kitformat auf wenige Arbeitsschritte und eine Gesamtanalysendauer von nur zwei Tagen komprimiert. Das entspricht einer Zeitersparnis von 60- 70 % gegenüber dem klassischen Verfahren und einem signifikant geringeren Materialaufwand. Damit ist das Verfahren nun nicht mehr auf einige wenige spezialisierte Labore limitiert, sondern kann flexibel und reproduzierbar auch in den Betriebslaboren der Hersteller für die Vitaminanalyse eingesetzt werden und so effizient zur Qualitätssicherung und Optimierung der Rezepturen beitragen.
Ausblick
Die VitaFast® zugrundeliegende Innovation wurde im Jahr 2006 patentiert. Im gleichen Jahr erfolgte auch die weltweite Markteinführung der Testkits durch die R-Biopharm AG (www.r-biopharm.com). Parallel dazu wurde im klinischen Bereich die auf demselben Grundprinzip basierende Produktlinie ID-Vit® für die Vitaminanalyse in humanem Serum und Vollblut von der Immundiagnostik AG (www.immundiagnostik.com) in den Markt gebracht und erfolgreich in medizinischen Laboratorien etabliert.
Das mikrobiologische Kitkonzept konnte übrigens auch in Übersee punkten. Fünf der zwölf VitaFast®-Produkte wurden inzwischen nach umfangreichen Validierungsstudien vom US-amerikanischen AOAC-RI(Association of Official Analytical Communities Research Institute) als Performance Tested Method zertifiziert.
Literatur
[1] Richards, M.B. & Simpson, B.W. (1934) Curative method of vitamin A assay, Biochemical Journal, 28, 602-621.
[2] Snell, E.E. & Strong, F.M. (1939) A microbiological assay for riboflavin, Industrial and Engineering Chemistry, Analytical Edition, 11 (6), 346-350.
[3] Weber, W. et al. (2011) Quantitation of vitamins using microbiological assays in microtiter formats, In: Rychlik, M. (Ed.) Fortification of foods with vitamins, First Edition, Wiley-VCH Verlag GmbH & Co. KgaA, 37-64.
[4] Newman, E.M. & Tsai, J.F. (1986) Microbiological analysis of 5-formyltetrahydrofolic acid and other folates using an automatic 96-well plate reader, Analytical Biochemistry, 154, 509-515.
Foto: © Tobias Hein
|