SERS-MikroskopieGezielte Proteinlokalisierung – eine aussichtsreiche Methode
Dr. Sebastian Schlücker,
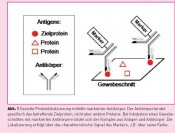
Zur Proteinlokalisierung in Zellen und Geweben werden oftmals markierte Antikörpereingesetzt, welche selektiv an das betreffende Zielprotein binden. Aufgrund dieser molekularen Erkennung bildet sich der entsprechende Antikörper-Antigen-Komplex (Abb. 1). Das charakteristische Signal des an den Antikörper gebundenen Markers, z. B. seine Farbe, ermöglicht dann die Lokalisierung des Antigens. Als Markierungsreagenzien werden bisher vor allem Enzyme, Farbstoffe und Fluorophore verwendet. Nachteilig ist dabei die eingeschränkte Möglichkeit zum Parallelnachweis(Multiplexing) vieler Zielproteine, bedingt durch die spektrale Überlagerung der einzelnen Markersignale. Im Gegensatz zu den breiten Emissionsbanden bei elektronischen Übergängen sind die Linienbreiten bei Schwingungs-Raman-Banden ca. 100 Mal schmaler. Dies ist die Grundlage für das enorme Multiplexing-Potenzial des Nachweises mittels Raman- Streuung. [1] Um die notwendige Sensitivität in der Bioanalytik zu erreichen, wird die oberflächenverstärkte Raman-Streuung (surface-enhanced Raman scattering, SERS) als Nachweismethode eingesetzt. Nanopartikel zur Verstärkung von Raman-Streuung
Zur Verstärkung der Raman-Streuung werden metallische Nanostrukturen eingesetzt.[2–3] Dabei nutzt man die optische Anregung von Oberflächenplasmonen,d. h. kollektiven Schwingungen des freien Elektronengases im Metall, aus. Die resultierende elektromagnetische Felderhöhung im Nahfeld der Metalloberfläche führt zu Verstärkungen des Raman-Signals von Molekülen um bis zu 14 Größenordnungen, bis hin zur Einzelmolekül-Sensitivität. Als metallische Nanostrukturen werden bei SERS oftmals sphärische Nanopartikel aus Silber und Gold mit Durchmessern von typischerweise 20–100 nm zur Verstärkung der Raman-Streuung eingesetzt (Abb. 2 links). Die Kombination aus organischen Raman-Markermolekülen auf der Oberfläche eines metallischen Nanopartikels wird als SERS-Marker bezeichnet (Abb. 2 Mitte).Zur effizienten Anregung von SERS muss die Plasmonenbande der Nanopartikel auf die Wellenlänge der Laseranregung abgestimmt sein. Genauso wie Enzyme, Farbstoffe oder Fluorophore, können auch SERS-Marker als Markierungsreagenzien an Antikörper konjugiert werden (Abb. 2 rechts), um auf diese Weise selektiv die entsprechenden Proteine nachzuweisen. SERS-Mikroskopie
Für den selektiven Proteinnachweis werden Antikörper an SERS- Marker konjugiert.[4,5] Dabei erhält man SERS-markierte Antikörper (Abb. 2B rechts). Die Herstellung des SERS-Markers erfolgt durch Zugabe der organischen Raman- Marker zum Metallkolloid, beispielsweise von aromatischen Disulfiden oder Thiolen zu Goldnanopartikeln. Die Metallpartikel wiederum werden ausgehend von Metallsalzen in Gegenwart von Stabilisatoren und Reduktionsmitteln mittelsklassischer Kolloidchemie synthetisiert. Die Stabilisierung von SERS-Markern durch Verkapselung, z. B. mit einer Glashülle, ist ein wichtiger Aspekt bei allen praktischen Anwendungen. [6]
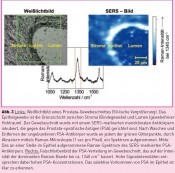
Durch Verwendung von roter bis nahinfraroter Laserstrahlung zur Minimierung der Autofluoreszenz lässt sich mittels SERS-Mikroskopie ein sehr guter Kontrasterzielen. Im Gegensatz zur Fluoreszenz-Mikroskopie stellt Photobleichen bei SERS kein Problem dar. Das herausragende Merkmal der SERS-Technologie ist das immense Multiplexing-Potenzial, kombiniert mit einer hohen Sensitivität und Photostabilität sowie einer hohen Qualität und Quantifizierbarkeit der Daten. Die simultane und quantitative Erfassung mehrerer Zielproteine in Gewebeschnitten könnte in Zukunft die Grundlage für eine verbesserte Tumordiagnostik bilden (Abb. 4).Nachteilig ist im Vergleich zu molekularen Fluorophoren die Größe der SERS-Marker. Für Oberflächenantigene, Zell- und Gewebeschnitte sowie Assays stellt dies jedoch kein Problem dar. Die simultane Detektion multipler Zielmoleküle spart Zeit und Kosten, zudem werden geringere Probenvolumina benötigt. Daher ist die größte Verbreitung der SERS-Technik zukünftig in der In-vitro-Diagnostik zu erwarten. Foto: © Dr. Sebastian Schlücker
[1] Y. C. Cao, R. Jin, C. A. Mirkin, Science 2002, 297, |
L&M 3 / 2008
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |