|
Forscher
>
Prof. Dr.-Ing. Annette Schafmeister
>
Therapeutische Antikörper auf ihrem Weg ins Gehirn
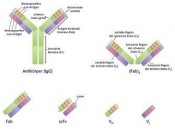
Therapeutische Antikörper auf ihrem Weg ins GehirnImmer der Nase nachBiopharmaka sind ein riesiger Absatzmarkt in der biotechnologischen Industrie. Während die Anzahl der neu zugelassenen chemisch-synthetisierten Arzneistoffe sinkt, steigt die Zahl der zugelassenen biotechnologisch- hergestellten Bio pharmaka. Die Pipelines von Pharma- und Biotechfirmen sind voll mit weiteren biopharmazeutischen Produkten. Biopharmaka sind überwiegend therapeutische Proteine wie Hormone (z. B. Insulin), Wachstumsfaktoren (z. B. Epo) oder therapeutische Antikörper (z. B. Herceptin). Therapeutische Antikörper stehen besonders im Fokus der Forschung und Entwicklung. Antikörper sind körpereigene Proteine, die in der Lage sind, fast jede nur denkbare Struktur (der Pharmakologe sagt dazu Target) mit dem Ziel zu erkennen, Pathogene und Krebszellen abzuwehren. Ein gesunder Mensch hat ein Repertoire von ca. 109 verschiedenen Antikörpern, mit deren Hilfe unser Immunsystem erfolgreich Krankheiten und Tumore abwehrt. Unsere Antikörper besitzen eine einheitliche Struktur. Ganz grob kann man sagen, dass ein Antikörper dem Buchstaben Y ähnelt. Er besitzt zwei Bindungsstellen, die wie zwei Arme von der Mitte des Moleküls ausgehen und die alles Körperfremde wie Viren und Bakterien erkennen und binden sollen. Die „Arme“ nennt man Fab (antigenbindendes Fragment). Den „Unterkörper“ des Y bildet die Fc-Region. Diese sieht bei jedem menschlichen Antikörper exakt identisch aus. Hat ein Antikörper sein Antigen gebunden, so ändert sich ganz leicht die 3D Struktur der Fc-Region. Wie eine Flagge, die nun gehisst wird, dient diese Änderung als Erkennungsmerkmal für das Immunsystem und damit für eine Immunreaktion. Auch als Arzneimittel sind Antikörper schon lange bekannt. Früher immunisierte man beispielsweise Pferde mit Schlangengiften oder Tollwuterregern. Das Immunsystem der Pferde produzierte daraufhin spezifische Antikörper gegen diese Strukturen, da sie als fremd erkannt wurden. Aus dem Blut der Pferde konnten anschließend die Antikörper gewonnen und den Patienten nach einem Schlangenbiss oder bei einer Tollwutinfektion verabreicht werden. Entwickelt wurde diese Form der passiven Impfung im Jahre 1890 von Emil von Behring. Heutzutage werden therapeutische Antikörper nicht mehr aus Tieren gewonnen, sondern biotechnologisch hergestellt. Vor allem aber werden therapeutische Antikörper heutzutage designt, das heißt, ihre genaue Struktur und Spezifität beruhen nicht mehr darauf, wie das Immunsystem die Moleküle „zusammen- würfelt“, sondern sie werden hochspezifisch an ihr Target und an den Wirkmechanismus angepasst (siehe Abb. 1). Monoklonale therapeutische Antikörper werden derzeit vor allem in der Krebstherapie, nach Transplantationen oder beispielsweise bei Rheuma mit großem Erfolg eingesetzt. Biotechnologisch lassen sich Antikörper gut designen und für fast jede Anwendung optimieren. Ein IgG (Immunglobulin G)-Antikörper besteht aus zwei schweren Ketten (in Abb. 1 grün dargestellt) und zwei leichten Ketten (violett dargestellt). Die eigentliche Bindung zum Antigen bzw. Target vermitteln Antigenbindungsstellen (rot), die sich auf der variablen Region der schweren und der leichten Kette befinden. Einen Antikörper kann man an verschiedenen Stellen zerlegen, sodass ein (Fab)2 oder zwei Fab entstehen. Diese Fragmente binden weiterhin das Target, werden aber vom Immunsystem nicht mehr als Antikörper erkannt. Biotechnologisch lässt sich auch das synthetische scFv (single chain variable-Fragment) herstellen, bei dem die variablen Bereiche der leichten Kette und der schweren Kette über einen Linker verbunden sind. Auch die kleinsten Fragmente das VH oder VL binden das Target, allerdings mit geringerer Affinität, da hier verglichen mit dem Fab oder scFv nur noch die Hälfte der Bindungsstellen zur Verfügung steht. Die Vorteile der kleinen Antikörperfragmente sind ihre kosteneffektive und schnelle biotechnologische Produktion und ihre geringe Größe und damit bessere Penetration von Zellen und Geweben. Außerdem ist es für einige Indikationsgebiete sehr wichtig, dass der biopharmazeutische Wirkstoff nicht mehr vom Immunsystem als Antikörper erkannt wird und damit auch keine Entzündungsreaktion auslösen kann. Gerade im Indikationsgebiet Neurologie und Psychiatrie versprechen therapeutische Antikörper in verschiedenen Modellen einen sehr effizienten Nutzen gegen schwere chronische Erkrankungen wie beispielsweise Demenzen, die bisher kaum ausreichend behandelt werden konnten. Die immense Anzahl der Alzheimer-Patienten, denen bisher keine wirklich erfolgreiche Therapie geboten werden kann, sowie die demografische Entwicklung drängen auf eine therapeutische Lösung für Demenzen. Aber auch zahlreiche andere Erkrankungen des zentralen Nervensystems wie Depressionen oder Schizophrenie belasten die Patienten und die Gesundheitssysteme. Ein Markt für zentral wirksame therapeutische Antikörper ist also vorhanden. Doch um im Gehirn wirken zu können, müssen Antikörper allerdings erst mal ins Gehirn kommen. Unser Körper hat aber eine Sicherheitszone um das Gehirn errichtet, die so genannte Blut-Hirn-Schranke. Gerade große Proteine überwinden diese schwer bis gar nicht, es sei denn, es gibt einen speziellen molekularen Transporter. Wie sollen also therapeutische Antikörper, die in In-vitro-Modellen sehr viel versprechende Wirkung zeigen, ins Gehirn kommen? Eine Lösung für dieses Problem könnte die Nase sein, denn Gehirn und Außenwelt treffen in der Nase direkt zusammen. Die Ausläufer der Riechsinnesnervenzellen (Neuronen) ragen direkt in das obere Gebiet der Nasenhöhle hinein (siehe Abb. 2; doch anatomisch ist dieser Bereich so geschützt, dass auch exzessives Nasebohren zu keiner Schädigung des Gehirns führt). Auf diesen Ausläufern sitzen Rezeptoren, mit deren Hilfe wir riechen können. Diese kleine Lücke zum sonst so gut abgeschirmten Gehirn bietet die einmalige Chance, Wirkstoffe nicht invasiv (also ohne Spritze) direkt ins Gehirn zu bringen. Appliziert werden kann in der Nase in Form von Aerosolen, z. B. Nasensprays. Es ist bekannt, dass sowohl chemisch-synthetisierte Moleküle als auch kleine Proteine über die Nase in das Gehirn aufgenommen werden; ein bekanntes (wenn auch nicht ganz legales) Beispiel hierfür ist Kokain, das über die Nase direkt ins Gehirn aufgenommen wird und dort seine bekannte Wirkung entfaltet. Da bis dato die meisten Untersuchungen über die intranasale Applikation überwiegend in präklinischen Experimenten ohne standardisierte Bedingungen durchgeführt wurden, ist wenig bekannt, welche Eigenschaften ein Aerosol haben muss, um ein Protein optimal auf die Nasenschleimhaut aufzubringen und welche Proteineigenschaften einen optimalen Transport gewährleisten. Untersuchungen zur intranasalen Applikation in In-vivo- Modellen zeigen eine überzeugende Wirkung dieser Applikationsart, allerdings unter Bedingungen, die wohl kaum auf den Menschen übertragbar sind. Das Institut für Pharmazeutische Biotechnologie der Hochschule Biberach hat es sich unter der Leitung von Prof. Dr. Katharina Zimmermann daher zum Ziel gesetzt, in einem validierten System zu testen, unter welchen Bedingungen Antikörperformate in ein geeignetes Aerosol zu überführen sind und welche Wirkungen unterschiedliche Aerosole auf ein Modell der nasalen Schleimhaut haben. Ebenso werden hierbei die Einflüsse verschiedener Antikörperformate auf ihren Transport, ihre Hirngängigkeit, Toxizität und biologische Wirksamkeit getestet. Das bedeutet: Wenn eine geeignete Methode für ein definiertes Antikörperformat über die Nase ins Gehirn gefunden wird, so sollte diese Methode auch auf andere Antikörperformate übertragbar sein. Einen biopharmazeutischen Wirkstoff gegen Alzheimer sollte man demnach ebenso über die Nase ins Gehirn applizieren können wie einen analogen biopharmazeutischen Wirkstoff gegen Parkinson oder Schizophrenie. Ein Nasenspray gegen die Leiden des Gehirns, so könnte die nahe Zukunft aussehen. Eine Zukunft, in der wir Medikamente für den individuellen Bedarf maßschneidern können, hat dank der enormen biotechnologischen Entwicklung im Bereich der therapeutischen Antikörper bereits begonnen. Jetzt müssen wir noch herausfinden, wie diese Medikamente immer der Nase nach ins Gehirn gelangen können. Foto: © Prof. Dr. Katharina Zimmermann |
L&M 5 / 2011
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |