|
L&M-2-2009
>
3-D-Chip: Diagnostik, Therapievorhersage und Therapiekontrolle bei Krebserkrankungen
3-D-Chip: Diagnostik, Therapievorhersage und Therapiekontrolle bei Krebserkrankungen
Prof. Dr. Andrea A. Robitzki, Sichere Vorhersage der besten Chemotherapeutika für Tumore – die Zukunft der Onkologie?
In der onkologischen Forschung wurden in den letzten Jahren zahlreiche neue Therapieansätze und Wirkstoffkandidaten ermittelt und erprobt. Der Fokus liegt häufig auf kombinatorischen Therapieansätzen, mit dem Ziel das Wachstum eines Tumors d. h. die Tumorzellteilung zu inhibieren und im optimalen Fall die Tumorzellen in den programmierten Zelltod zu treiben. Derartige Ansätze führen jedoch nicht immer schnell und kostengünstig genug zu neuen, sicheren und wirkungsvollen Wirkstoffen bzw. Therapeutika, da deren Entwicklung zunehmend komplexer wird und immer mehr systemisch zu betrachten ist. Bei einem um ein Vielfaches erhöhten Mitteleinsatz durch die pharmazeutisch-chemische Industrie sinkt die Anzahl der Zulassungsanträge und Zulassungen. Im Durchschnitt dauert die Entwicklung für Arzneistoffe bis zur Marktreife und Zulassung zehn bis fünfzehn Jahre, nur 8 % der Wirkstoffkandidaten kommen über Phase I der klinischen Studien hinaus, die Chemosensitivität kann häufig nicht immer gesichert definiert werden. Heute sind präklinische Testverfahren nicht ausreichend in der Lage, hinsichtlich Sicherheit oder klinischer Wirksamkeit eines Wirkstoffkandidaten, auch im Hinblick auf eine personifizierte Patientenmedikation, prädiktiv zu agieren. Aus diesem Grund müssen neue innovative Methoden und Technologien erarbeitet werden. Im Fokus unserer Entwicklungen steht eine Chip-Technologie zur schnellen, eindeutigen und zuverlässigen Vorhersage von chemischen Wirkstoffen, Protein- und Peptid-basierten Therapeutika und Therapieformen u. a. im Bereich Tumorerkrankungen. Ein schnelles, prädiktives funktionelles Hochdurchsatz-Screening unter Einsatz organotypischer Gewebekulturmodelle bzw. – äquivalente und Patienteneigenen Biopsien mit Echtzeitmonitoring auf 3-D-Mikrokavitäten- Biochips würde Fehlschläge in der präklinischen Entwicklungsphase um ca. 20 – 30 % reduzieren, d. h. bereits 10 % entsprächen nach aktuellen Studien einer Einsparung von ca. 100 Mio. US$, aber auch eine höhere Sensitivität im Therapieverlauf garantieren. Im Bereich der präklinischen Phase können Targetvalidierung und gezielte Wirkungsnachweise in organotypischen Gewebesystemen kostengünstig und sicher optimiert werden. Ein Teilbereich der vorklinischen Entwicklung könnte somit bereits hinsichtlich Pharmakologie und Pharmakokinetik an geeigneten organotypischen in-vitro- Tumormodellen, z. B. Wirkstoffeffekte auf neuen Biochipsystemen in kürzerer Zeit realisiert werden. Aber auch der Aspekt der Pharmakogenomik, d.h. der personifizierten, individuellen Patientenreaktion auf Chemo- therapeutika bzw. die Wirkstoffresistenz der Tumore und/oder Metastasen könnten künftig in kürzester Zeit vorhergesagt werden. Am Biotechnologisch-Biomedizinischen Zentrum der Universität Leipzig wurde kürzlich ein neuartiger 3-DBiochip entwickelt, mit dem innerhalb von Sekundenbruchteilen die Wirkungen und mögliche Nebenwirkungen von Chemotherapeutika in vitalen dreidimensionalen Tumormodellen sowie Patientenbiopsien getestet werden können. Im Gegensatz zu konventionellen Methoden kann das Tumorgewebe im Lebendzustand und somit manipulations-, markierungs- und zerstörungsfrei in seinem Ist-Zustand beschrieben und seine Reaktion auf potenzielle Chemotherapeutika bestimmt werden. Das bioelektronische Screening erlaubt einerseits eine Sofort- bzw. Echtzeitantwort, aber auch andererseits Online-Messungen über längere Zeiträume, um so Langzeiteffekte der Wirkstoffe zu untersuchen (Abb. 1). Der bioelektronische Fingerabdruck für jeden Tumor
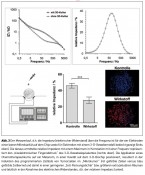
Der Neuheitsgrad des 3-D-Biochip-Systems ist dessen Oberfläche mit ?m-großen Mikrokavitätenstrukturen und einer 4-Elektrodenanordnung in den Wandbereichen. In diesen Kavitäten- oder Töpfchen-Mikrostrukturen können vitale Tumorgewebe bzw. Patienten-eigenes Tumormaterial positioniert und die Aggressivität im Hinblick auf Tumorwachstum, Tumorzellteilung und Wirkstoffresistenz elektronisch gemessen werden (Abb. 2). Zur Positionierung und sensitiven bioelektronischen Analyse von 3-D-in-vitro-Tumormodellen konnte ein neues Design eines Mikrokavitätenarrays entwickelt und ein Prototyp aus Silizium mit Goldelektroden gemäß eines nass-chemischen Ätzund photolithographischen Verfahrens gefertigt werden. Jeder Chip besitzt zur optimalen Ausnutzung aller 60 Kontakte ein Layout mit 15 Kavitäten mit Abmessungen von 200 ? m bis 400 ? m und einer Tiefe von 100 ? m, welche mit jeweils vier Elektroden an den schrägen Außenwänden ausgestattet sind. „Gesendet“ wird in einem Frequenzbereich von 10 Hz bis 100 MHz und „empfangen“ wird im Sinne von Impedanzmaximum- Änderungen bei 100 kHz. Für die verschiedenen Tumorproben können so in Abhängigkeit ihrer Eigenschaften d. h. ihrer Zell-/Packungsdichte und Oberflächenstruktur ein bioelektronischer oder biomimetischer Fingerabdruck erhoben und zugeordnet werden [3]. Das Forschungsvorhaben verfolgte bzw. berücksichtigte die gesamte Wertschöpfungskette von der mikrosystemtechnischen Entwicklung, der Integration in portable Geräte sowie die Implementierung in Robotik- und Mikrofluidik-Automatisierungsplattformen des (a) in vitrodiagnostischen, klinischen Parts und (b) des Wirkstoff-entwickelnden und -testenden Industriezweiges. Das „bioelektronische Screening“ erlaubt einerseits Sofortantworten und andererseits auch Messungen über längere Zeiträume an Biopsie-Proben, um so die Wirkung von Therapieansätzen aber auch Nebenwirkungen der avisierten Wirkstoffe auf andere Organgewebe des Körpers zu untersuchen. Durch die in Mikrokavitäten positionierten biologischen Probenmaterialien, die von vier Mikroelektroden kontaktiert werden, wird frequenzabhängig im Hertz- bis Mega-Hertz-Bereich Wechselstrom geleitet. Der elektrische Widerstand ist frequenzabhängig und spiegelt in bestimmten „Sendebereichen“ spezifische Empfängersignale wider, die an Änderungen in Tumor und letztlich der Tumorzellen im Zellverband gekoppelt sind. Wie senden Tumore auf einem Chip Signale?
Ein Prinzip der funktionellen Messmethodik ist die Bioimpedanzspektroskopie [1,2]. Das Prinzip der Impedanz beruht auf dem Zusammenhang der Elektrizitätslehre und ihren elektrischen Kenngrößen Spannung, Stromstärke und Widerstand im elektrischen Schaltkreis, der durch das Ohmsche Gesetz beschrieben wird. Zusätzliche elektrische Bauelemente wie Kondensatoren und Spulen beeinflussen den Stromfluss im Gleichstromkreis lediglich durch ihren materialabhängigen Ohmschen Widerstand (Spule) oder indem sie den Stromfluss nach kurzer Zeit komplett sperren (Kondensator). Liegt dem Stromkreis jedoch eine Wechselspannungsquelle an, ändert sich die Wirkung dieser Komponenten. Wechselspannung bedeutet, dass sich die Polarität der angelegten Spannung periodisch ändert. Der Gesamtwiderstand aus Ohmschen- und Blindwiderstand des Wechselstromkreises ist die Impedanz, also der Scheinwiderstand. Elektrische Impedanzmessungen erfassen somit die Strom-Spannungs-Verhältnisse an Elektroden unter konstanten Wechselstrombedingungen [3–5]. Untersucht werden so die Auswirkungen auf physiologisch- chemische Prozesse in lebenden Tumorzellen, die als dielektrische Körper mit einem ihnen eigenen elektrischen Schaltkreis zu betrachten sind, wie Zellteilung, programmierter Zelltod, Nekrose oder Zellalterung infolge von Wirkstoffeinflüssen oder externen Signalen [6,7]. Hautkrebsproben auf dem Mikrokavitätenchip und ihre Wirkstoffresistenz Auf der Basis von humanen 3-D-Melanomzellaggregaten wurde der Zelltod-induzierende Effekt einiger Chemotherapeutika als Modellwirkstoffe konzentrations- und zeitabhängig untersucht. Das Monitoring erfolgte auf 3-D-Mikrokavitätenarrays mit Kavitäten von 300 ?m und eines entwickelten Software-gesteuerten Imagingverfahrens hinsichtlich einer optimalen Gewebepositionierung an den vier Elektroden. Die Impedanzmaxima bei 100 bis 133 kHz bezüglich nicht-behandelter und behandelter Melanome wurden in einem Zeitfenster von 8 h in Echtzeit und online ermittelt (Messzeit in msec). Die Impedanzanalyse erbrachte in Echtzeit ultraschnell die erwartete Wirkung des Chemotherapeutikums, d.h. Inhibition der Tumorzellvermehrung im „Mikrotumor“ bzw. Induktion des programmierten Zelltods (Abb. 3). Jedoch konnten an diesem Tumormodell auch völlig unerwartete Ergebnisse für einige Chemotherapeutika ermittelt werden. Wider Erwarten wurde z. B. ein signifikanter Anstieg der Impedanz für einige der Substanzen detektiert, was eigentlich für eine vermehrte Zellteilung und somit eine höhere „Packungsdichte“ des Melanoms spricht. Dies beAbb. 3 Der Messverlauf, d.h. die Impedanz (elektrischer Widerstand) über die Frequenz ist für die vier Elektroden einer leeren Mikrokavität auf dem Chip sowie für Elektroden mit einem 3-D-Gewebemodell bedeckt gezeigt (links oben). Die daraus ermittelte relative Impedanz mit einem Maximum in Korrelation mit einer Frequenz repräsentiert den „bioelektronischen Fingerabdruck“ des 3-D-Gewebeäquivalentes (rechts oben). Die Applikation eines Chemotherapeutikums auf ein Melanom, in einer Kavität auf dem 3-D-Biochip positioniert, resultiert in der Induktion des programmierten Zelltods von Tumorzellen im „Mikrotumor“ (rot gefärbte Zellen versus blau gefärbte Zellkerne) und damit in einer geringeren „Zell-Packungsdichte“ bzw. größeren extrazellulären Räumen und letztlich in der Abnahme des elektrischen Widerstandes, d.h. der relativen Impedanz (unten). deutet, dass der zerstörerische Effekt einiger Wirkstoffe sich nicht gravierend auf das komplexe Melanommodell auswirkt und die Zelldichte per Volumeneinheit von Zellteilungsereignissen sogar überdeckt wird und unverändert bleibt, was in Echtzeit und online auch über die Impedanz sensitiv wiedergegeben wird. Somit konnte erstmals mit diesem 3-DBiochip ein Verfahren aufgezeigt werden, das sich künftig für die Chemosensitivitätsprüfung von Chemotherapeutika am vitalen Tumormodell online eignen würde [4]. Nach erfolgter Zertifizierung stünde künftig für die Diagnostik und personifizierte Tumortherapie auf der Basis von Patientenproben, d.h. im Sinne einer „Individualtherapie“ ein sicheres Vorhersage-Instrument bezüglich der Therapiewahl und Medikation gemäß den besten Erfolgsaussichten zur Wahl. Die Entscheidung würde bei Einsatz des Chips auf der Basis sicherer Daten erfolgen können. Fotos: © Prof. Dr. Andrea A. Robitzki
Literatur: |
L&M 2 / 2009
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |