|
Chemische Ökologie und Verwendung als Pharmaka
Chemische Ökologie und Verwendung als PharmakaWirkstoffe aus InsektenInsekten und andere Arthropoden produzieren eine unglaubliche Zahl chemisch unterschiedlicher Naturstoffe [1]. Die chemischen Strukturen und die biologische Signifikanz dieser Verbindungen werden seit vielen Jahren von der chemischen Ökologie erforscht. Viele Substanzen haben eine Lockwirkung (Pheromone), warnen beispielsweise Beutetiere vor anwesenden Räubern (Kairomone) oder dienen einfach der eigenen Abwehr (Allomone, Abwehrstoffe, Gifte). Am Lehrstuhl für Tierökologie II der Universität Bayreuth werden seit vielen Jahren vor allem der Abwehr dienende Wirkstoffe aus Insekten und anderen Arthropoden untersucht. Hierbei ist von Bedeutung, dass manche dieser Naturstoffe chemisch komplexere Strukturen aufweisen und in manchen Fällen sogar Leitstrukturen für die Entwicklung neuer Wirkstoffe und Pharmaka für Menschen und Tiere darstellen. Wie anhand einiger Beispiele gezeigt wird, werden die Wirkstoffe oft vom Insekt selbst produziert, zum Teil werden Vorstufen auch aus Pflanzen oder anderen Tieren aufgenommen oder es kommen symbiontische Mikroorganismen als Wirkstoffproduzenten infrage. Oxalsäure zur Abwehr Viele Pilzmückenlarven (Mycetophilidae) leben in selbst hergestellten, aus Seide bestehenden Fäden, die z.T. mit Flüssigkeitströpfchen bedeckt sind. Manchmal finden sich diese extrem sauren (Abb.1), aus Oxalsäure bestehenden Flüssigkeitströpfchen auch im Kokon (Abb.2), der die Puppe umgibt. Die Tröpfchen dienen einerseits der Abwehr von Räubern, Pilzen oder Bakterien, andererseits ist bei manchen Pilzmückenlarven bekannt, dass die extrem sauren Oxalsäuretröpfchen dazu dienen, kleine Beutetiere zu fangen und zu töten. Inwieweit die Oxalsäure aus Basidiomyceten der Nahrung entnommen bzw. von den Larven selbst hergestellt wird, muss weiteren Untersuchungen vorbehalten bleiben [2]. Die giftige Oxalsäure wird als verdünnte, wässrige Zuckerlösung von Imkern zur Bekämpfung der Varroa-Milbe eingesetzt.
Abb.1 Pilzmückenlarve (Mycetophilidae) mit Oxalsäuretröpfchen
Abb.2 Pilzmückenpuppe (Mycetophilidae) mit Oxalsäuretröpfchen und rot gefärbten Universalindikatorpapier
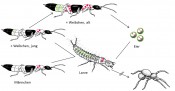
In Symbiose gegen Spinnen und Tumore Besonders interessant ist das zu den kompliziertesten Insektengiften gehörende Pederin, welches von italienischen Forschern erstmals aus Kurzflügelkäfern der Gattung Paederus (Abb.3) isoliert wurde. Die Käferweibchen geben das auch für Säuger hautreizende Polyketid über die Eier an die Nachkommenschaft, d.h. Larven, Puppen und Imagines weiter (Abb.4) und schützen sich mit diesem Wirkstoff vor dem Fraß durch Spinnen, ihren ärgsten Feinden [2-4]. Pederin und einige Derivate werden allerdings nicht von den Käfern synthetisiert, sondern sind das Produkt symbiontischer Bakterien der Gattung Pseudomonas im Inneren der Käferweibchen. Kurz vor der Eiablage werden die Käferweibchen ihre Symbionten dazu veranlassen, Pederin und andere Polyketide zum Imprägnieren der Eier zu produzieren. Gleichzeitig bedecken die Weibchen die Eioberfläche mit einem Symbiontenschleim (Abb.4), sodass auch die Nachkommen nach Fraß der Eischale und Aufnahme der Symbionten in der Lage sind, den Wirkstoff zu bilden [4].
Abb.3 Polyketid Pederin mit Antitumorwirkung aus bakteriellen Endosymbionten von Kurzflüglern der Gattung Paederus
Abb.4 Kreislauf des Pederins (rote Punkte) sowie der symbiontischen Pseudomonas-Bakterien (grün) in verschiedenen Entwicklungsstadien des Kurzflüglers Paederus spec. Schon geringe Mengen von Pederin in Eiern, Larven oder Käfern reichen für eine Deterrentwirkung auf Spinnen aus.
Bemerkenswert ist die Fähigkeit des die Proteinbiosynthese hemmenden Pederins, bestimmte Tumore im Wachstum zu hemmen [5]. Auch aus marinen Schwämmen, die ebenfalls über nahe verwandte symbiontische Bakterien wie Paederus verfügen, konnten ähnliche, das Tumorwachstum hemmende Verbindungen isoliert werden, sodass mittlerweile mehrere Dutzend Polyketide aus der Pederinfamilie existieren. Auch konnte in den Paederus-Bakterien durch die Arbeitsgruppe von J. Piel (Zürich) Universalgift und Droge Ein weiteres Hämolymphgift ist das Terpenanhydrid Cantharidin, das in Ölkäfern (Meloidae) und Schenkelböcken (Oedemeridae) offenbar aus Vorstufen von den Käfern selbst hergestellt und bei Gefahr durch Reflexbluten abgegeben wird (Abb.5). Die hautreizende, das Urogenitalsystem des Menschen schädigende und zu schmerzhaften Erektionen führende Verbindung hemmt wie die in marinen Biotopen vorkommende Okadasäure die Proteinphosphatase 2A [1,3,7]. Das Universalgift dient manchen Insekten auch als Droge, wird dann begierig aufgenommen und per Kopula vom Männchen ins Weibchen und im Anschluss in die Eier transferiert [1,3,7]. Da Cantharidin und seine für Säuger inklusive Mensch weniger giftigen natürlichen und synthetischen Analoga verschiedene Tumorzelllinien des Menschen inhibieren, stellen gerade diese Terpene interessante Leitstruktur für die Pharmaforschung dar. Norcantharidin (Abb.5 Mitte rechts) wird beispielsweise in China in der Krebstherapie eingesetzt, denn es hemmt zahlreiche Tumorzelllinien und zeigt im Vergleich zum giftigen Cantharidin kaum Nebenwirkungen. Auch 5,6-Dehydrocantharidin (Abb.5 oben rechts) weist eine deutliche Antitumorwirkung auf [5].
Abb.5 Giftiges Terpen Cantharidin (rechts unten) wird von gereiztem, auf dem Rücken liegenden Ölkäfer der Gattung Meloe zur Abwehr abgegeben. Das Phänomen heißt Reflexbluten. Zwei Analoga mit Antitumorwirkung und im Vergleich zu Cantharidin geringerer Säugertoxizität sind oben dargestellt.
Aus dem Darm des Rosenkäfers Ebenfalls spannend ist die Geschichte einer neuartigen Naturstoffgruppe, die aus Darmbakterien (Actinomyces) des Rosenkäfers (Cetonia aurata) isolierten Cetoniacytone [5] (Abb. 6). Die Verbindungen, die durch die Zusammenarbeit von Bayreuther Entomologen, Tübinger Mikrobiologen (H.-P. Fiedler), Göttinger Chemikern (A. Zeeck) und der BASF Ludwigshafen isoliert werden konnten [8], wirken gegen Leber- und Brustzellkarzinome, aber auch gegen Arthrithis. Mittlerweile wurde 2009 das Gencluster isoliert, das für die Biosynthese der Cetoniacytone verantwortlich ist [9]. Erstaunlich ist, dass man nicht weiß, ob diese Verbindung nur in der Petrischale oder tatsächlich auch im Rosenkäferdarm produziert und dort verstoffwechselt wird.
Abb.6 Aus dem Enddarm des Rosenkäfers Cetonia aurata isolierter Actinomycetes-Stamm produziert neuartige Cetoniacytone, welche das Wachstum diverser Tumore hemmen.
Übers Wasser katapultiert Vor mehreren Jahren wurde von Schildknecht in Heidelberg aus Kurzflüglerkäfern der Gattung Stenus neben diversen Terpenen (z.B. a-Pinen; 1,8-Cineol) mit Stenusin (Abb.7) ein chemisch ungewöhnliches tierisches Alkaloid isoliert [10]. In paarigen abdominalen Wehrdrüsen speichern die Kurzflügler ein kompliziertes Abwehrstoffgemisch, das vor allem gegen die natürlichen Gegenspieler, d.h. insbesondere Spinnentiere zum Einsatz kommt (Abb.7). Zusätzlich vermag Stenusin auf der Wasseroberfläche blitzartig einen monomolekularen Film zu bilden, ein Vorgang, der als Spreitung bezeichnet wird. Die Spreitungsschwimmer der Gattung Stenus geben bei Reizung ein alkaloidhaltiges Tröpfchen auf die Wasseroberfläche. Die spreitenden Substanzen im Wehrsekret katapultieren die auf der Wasseroberfläche laufenden Käfer (USA: „Jesus-Christus-Käfer“) wie eine Rakete in bestimmte Richtungen. Für die Spreitungsschwimmer stellt dies ein ungewöhnliches Fluchtverhalten dar. In Zusammenarbeit mit Bayreuther Chemikern (K.-H. Seifert) sind mittlerweile zahlreiche neuartige Derivate dieses Käferalkaloids aufgeklärt worden, darüber hinaus wurde deren Biosynthese untersucht [10].
Literatur Bild: © istockphoto.com| nechaev-kon, defun |
L&M 10 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |