|
Forschung & Entwicklung
 >
Stammzellen - Tumorforschung
>
Stammzellen - Tumorforschung
Stammzellen - TumorforschungDer Entstehung von Krebs auf der Spur
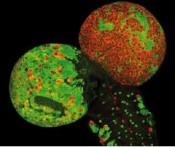
Stammzellen und wie daraus ein Tumor wird, ist bei der Fliege besser verstanden als in jedem anderen Organismus. Stammzellen-Detektive im Labor - Auf der Spur der Entsteh- ung von Krebs ist dem Spürnasen-Team um Dr. Jürgen Knoblich am Institut für Molekulare Biotechno- logie ein Durchbruch gelungen – sie konnten ein Gen identifizieren, das bei der Tumor-bildung eine entscheidende Rolle spielt. Das Gen mit dem Namen Brat braucht allerdings kein Alibi, Nur wer versteht, wie Krankheiten entstehen, kann sie eines Tages heilen. Ein Tumor beispielsweise entwickelt sich, wenn Zellen sich unbeschränkt vermehren und die Kontrolle über die Zellteilung verloren geht. Herauszufinden, wie Zellen ihre Teilung steuern und welche molekularen Bremsen sie haben um unkontrollierte Zellteilung zu verhindern, ist deshalb ein vorrangiges Ziel der Tumorbiologie. Abb. 1: Ein Tumor in Fliegen: Fehlt Brat, teilen sich die Stammzellen unkontrolliert und es entsteht ein Gehirntumor. Das Bild zeigt das Gehirn einer Fruchtfliege (Fotomontage) während der Entwicklung: im Normalfall (links) bilden wenige Stammzellen (rot) die vielen Nervenzellen (grün), die für die normale Funktion des Hirns verantwortlich sind. In -Abwesenheit des Brat-Gens (rechts) sind Stammzellen nicht mehr in der Lage, Nervenzellen zu produzieren. Sie verwandeln sich stattdessen in Tumorstammzellen, die das gesamte Gehirn überwuchern. Es kommt zur Ausbildung eines gigantischen Tumors, der die Fliege schließlich tötet. © IMP/IMBA Eine Revolution in der Tumorforschung
In den letzten Jahren gab es eine kleine Revolution auf diesem Gebiet. Glaubte man früher, dass ein Tumor einfach aus einer Ansammlung „wild gewordener“ Zellen besteht, so geht man heute davon aus, dass ein Tumor eher wie ein körpereigenes Organ aufgebaut ist. Wie im Organ gibt es wenige Stammzellen, die alle anderen Zellen im Tumor erzeugen können. Für einige Tumorarten, wie zum Beispiel Leukämie, ist diese Theorie -inzwischen weitgehend anerkannt, während sie für andere nur eine Hypothese darstellt. Von der Theorie zur Therapie In der Tumorforschung wird deshalb fieberhaft daran gearbeitet, neuartige Therapien zu entwickeln, die gezielt die Tumorstammzellen zerstören und deren Fähigkeit beeinträchtigen, den Tumor zu regenerieren. Derzeit gibt es solche Therapien nicht, vor allem deshalb weil wir weder wissen wie Stammzellen ihre Teilung kontrollieren, noch was aus einer normalen Stammzelle eine bösartige Tumorstammzelle macht. Stammzellen haben nämlich eine besondere Eigenschaft. Im Gegensatz zu anderen Zellen teilen sie sich „asymmetrisch“, das heißt die beiden Tochterzellen sind verschieden und nehmen ein unterschiedliches Schicksal an [1]: Eine der beiden Tochterzellen bleibt Stammzelle und sorgt dafür, dass Stammzellen ein unerschöpfliches Reservoir der zellulären Erneuerung darstellen. Die andere aber hört auf sich zu teilen und ersetzt verbrauchte oder zerstörte Körperzellen. Diese asymmetrische Zellteilung ist allen Stammzellen gemeinsam und ist der Grund, warum solche Zellen von enormer Bedeutung für die Therapie von Gewebeschäden aller Art sind. Brat – ein Regulator der Stammzellproliferation
Bei der Suche nach den Mechanismen dieser asymmetrischen Zellteilungen ist uns nun ein Durchbruch gelungen, der erklären könnte wie aus einer normalen Stammzelle eine Tumorstammzelle wird. Unser Objekt der (Wissens-) Begierde dabei ist die Fruchtfliege, Drosophila melanogaster. Die meisten von uns kennen Fruchtfliegen nur aus dem Obstkorb oder dem vergessenen Abfalleimer. Für uns aber sind Fruchtfliegen eine unproblematische Alternative zu Tierversuchen mit Mäusen und Ratten. In Wirklichkeit sind die Fruchtfliegen sogar der am besten untersuchte mehrzellige Organismus überhaupt. Es stellte sich heraus, dass etwa 2/3 aller menschlichen Krankheitsgene auch bei Fliegen vorhanden sind und dass Fliegen – wie wir – Stammzellen haben und eben auch Tumore bekommen können. Es ist sogar so, dass die Stammzellen und wie sie sich asymmetrisch teilen in Fliegen besser verstanden sind als in jedem anderen Organismus – Grund genug zu fragen, ob auch bei Fliegen Stammzellen für die Tumorentstehung verantwortlich sind. Und wie geht’s weiter? Warum ist das nun so interessant? Erstens gibt es das Brat-Gen auch beim Menschen und Experimente, seine Funktion zu untersuchen, sind bereits voll im Gange. Viel wichtiger ist aber, dass wir mit der Fliege nun ein Werkzeug haben um auch andere Gene zu finden, die ähnliche Eigenschaften haben und Stammzellen in Schach halten um Tumore zu vermeiden. Durch eine neuartige Bibliothek und Fliegenstämme, die an unserem Institut erzeugt wurden, können wir das sogar ganz systematisch machen. Mithilfe dieser Bibliothek können wir jedes der etwa 13.000 Fliegengene ganz gezielt in Stammzellen ausschalten und nachsehen, ob sich ein Tumor ausbildet [4]. Wir haben bereits eine Reihe solcher Gene gefunden und man kann gespannt sein, welche Funktion sie in menschlichen Stammzellen haben werden. Eine Tumortherapie, die gezielt auf Stammzellen angesetzt ist, ist damit zwar noch nicht erreicht. Medikamente, die in Zukunft solche Stammzellregulatoren beeinflussen können, haben aber eine gute Chance, eine solche Therapie in den Bereich des Möglichen zu rücken. Die vielen Stunden, die wir mit dem Kreuzen und Sezieren von Fruchtfliegen verbringen, wären damit sicherlich reichlich entlohnt.
Literatur: Bildquelle: © IMP/IMBA |
L&M 3 / 2009
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |