|
Forscher
>
Dr. Maximilian Freund
>
Die Säurekorrektur ist eine Herausforderung – nicht nur für die jüngere Winzergeneration
Die Säurekorrektur ist eine Herausforderung – nicht nur für die jüngere WinzergenerationAltes Wissen, neue VerfahrenZwischen Wetter und Weinqualität bestehen klare Zusammenhänge und somit lassen sich in Abhängigkeit von den klimatischen Bedingungen der jeweiligen Weinbaugebiete auch die unterschiedliche Verteilung der Weininhaltsstoffe und die daraus resultierenden Weintypen erklären. Ein Winzer muss auf unterschiedliche Traubenzusammensetzungen reagieren, um typische, harmonische, bei extremen Witterungssituationen, wie sie in unseren gemäßigten Klimaten in Deutschland vorherrschen können, auch bekömmliche Weine zu erzeugen. Der Jahrgang 2010 kann in den deutschen Weinbaugebieten als ein solches Extrembeispiel angeführt werden. Er brachte ein Thema in Erinnerung, da seit rund zwanzig Jahren eigentlich keines mehr war und teilweise nur aus den Fachbüchern bekannt ist – nämlich ein Zuviel an Säure. Bedeutung der Säuren Neben zahlreichen chemischen Verbindungen gehören die verschiedenen organischen Säuren zu den bedeutendsten Inhaltsstoffen des Weines und nehmen im Wesentlichen Einfluss auf deren Geschmacksempfindung „sauer“. In idealer Konzentration lassen sie den Wein frisch und fruchtig schmecken, in zu hoher Dosis aber überwiegt der saure Eindruck und die Weine werden unharmonisch, dagegen fehlt bei einem zu geringen Gehalt an Säure den Weinen die Frische und Fruchtigkeit. So ist es kaum verwunderlich, dass die Frage nach dem Säuregehalt eines Weines eine der meistgestellten beim Weinkauf ist. Aber nicht nur die organoleptischen Eigenschaften der Säure spielen eine bedeutende Rolle, sondern auch für den Winzer selbst und dessen Vorgehensweise bei der Weinbereitung haben der Säuregehalt bzw. der mit der Säure korrelierende pH-Wert große Bedeutung. So werden die mikrobielle Stabilität sowie das Ausmaß der möglichen Bildung von aromawirksamen Estern und die Polymerisationsneigung der farbgebenden Anthocyane bei Rotweinen sehr stark von Säure und pH-Wert bestimmt. Auch hängen Eigenschaften wie der Dissoziationsgrad oder die Ionenladung bestimmter Weininhalts- und Behandlungsstoffe und deren Reaktionsverhalten vom Säuregehalt bzw. dem pHWert eines Weines ab. Schwankungsbreite Wie der Jahrgang 2010 zeigt, unterliegt der ebenso wie der Gehalt des Alkohols größeren natürlichen Schwankungen. Der Säuregehalt eines Weines selbst hängt nun vor allem von der Traube und ihren klimatischen Wachstumsbedingungen ab. Weine wärmerer Gefilde wie aus dem Süden Europas weisen niedrigere Säurewerte auf als solche aus gemäßigten Klimaten wie z. B. aus Deutschland. Daneben spielt der jeweilige Jahrgang eine bedeutende Rolle. Temperatur, Sonnenscheinstunden und Nieder schlagsmenge und -verteilung nehmen großen Einfluss auf die Reife und den Gesundheitszustand der Trauben und somit auch auf deren Säurekonzentration und -zusammensetzung. Zusätzlich wird noch zwischen säurereichen und -armen Rebsorten unterschieden, die trotz derselben klimatischen Rahmenbedingungen unterschiedliche Säuregehalte aufweisen. In Abhängigkeit von den genannten Größen kann somit die titrierbare Gesamtsäure in Weinen zwischen 5 und 12 g/L schwanken. In warmen Regionen, sehr reifen Jahren und bei säurearmen Sorten kann diese bis auf 3 bis 4 g/L sinken bzw. in unreifen Trauben unter besonders ungünstigen Verhältnissen bis 20 g/L und noch höher ansteigen, wobei dies in den letzten Jahrzehnten die Ausnahme war. So ist der Jahrgang 2010 in Deutschland mit einer Mostsäure von teilweise über 15 g/L im Vergleich zu den vergangenen sonnenreichen Jahrgängen mit Mostsäuregehalten zwischen 7 und 9 g/L ein sehr säurereicher Jahrgang, der ohne Säurekorrektur nur für extreme Säureliebhaber genießbar wäre. Möglichkeiten Um auf diese Schwankungen reagieren und die Geschmacksharmonie der Weine beeinflussen sowie die mikrobielle Stabilität vor allem im Moststadium gewährleisten zu können, wurden im Laufe der langen Weinbereitungsgeschichte verschiedene önologische Verfahren entwickelt, mit denen dem Winzer die Möglichkeit des Beeinflussens gegeben ist und die neben den weinbaulichen Möglichkeiten im Rahmen des önologischen Säuremanagements zur Anwendung kommen können. Diese Verfahren beinhalten die Beeinflussung durch Variation mancher Prozessschritte während Weinbereitung genauso wie den Einsatz biologischer, chemischer und seit neuerem physikalischer Methoden. Mit diesen verschiedenen Möglichkeiten ist unter Beachtung der natürlich gegebenen Most- bzw. Weineigenschaften und des Verbraucherschutzes eine mehr oder weniger starke Säurekorrektur nach oben oder unten möglich. Je nach Richtung der Korrektur wird von einer Entsäuerung bei Säureminderung bzw. Säuerung bei Säureerhöhung gesprochen. Während die verfahrenstechnischen Möglichkeiten wie Wahl des Lesezeitpunktes und mehr oder weniger langes Stehenlassen der eingemaischten Trauben sowie der biologische Säureabbau natürliche und seit altersher bekannte Verfahren darstellen, unterliegen vor allem die chemischen und physikalischen Verfahren gesetzlichen Reglementierungen, da sie ein mehr oder weniger starkes Eingreifen in die Zusammensetzung des Weines ermöglichen. Erlaubte Methoden, Zeitpunkt und Höhe der Säurekorrektur in Abhängigkeit der Weinbauregion sind so beispielsweise vorgeschrieben. Die Säurekorrektur kann grundsätzlich bereits im Most- oder später im Weinstadium durchgeführt werden. Da aber je nach Höhe der Säurekorrektur die Vorteile oft aufseiten einer Mostbehandlung liegen, wird diese meist einer Weinentsäuerung vorgezogen. Säuren im Wein
Die Auswahl des vom Winzer genutzten Verfahrens hängt in erster Line von der Art und Menge der im Most bzw. im Wein vorhandenen Säuren und deren Eigenschaften, aber auch vom Ausmaß der Korrekturspanne ab. Chemische Möglichkeiten Die beiden Säuren Äpfel- und Weinsäure sind nicht nur aufgrund ihres Mengenanteils zum vorwiegend Teil am sauren Geschmack beteiligt sondern sind sie auch die Substanzen, über deren Minderung bzw. Erhöhung der Säuregehalt im Most- oder später im Weinstadium korrigiert wird. Die chemischen Möglichkeiten zur Säurekorrektur stellen die einfachste und derzeit meist praktizierte Möglichkeit dar. Im Falle der Säuerung ist es ein einfaches Zugeben der im Wein vorkommenden Hauptsäuren Weinsäure, Äpfelsäure oder Milchsäure in dem vom EU-Gesetzgeber vorgeben Mengen – 1,5 g/L im Most bzw. 2,5 g/L im Wein. Dagegen sind traditionelle Verfahren wie das Gipsen mit Caliciumsulfat und das Phosphatieren mit Calciumhydrogenphosphat von Traubenmaische oder Mosten verboten. Bei diesen Verfahren wird das einwertige Kalium des natürlich vorkommenden Weinsteins (Kaliumhydrogentatrat) durch das zweiwertige Calcium ersetzt. Dadurch wird ein Molekül der zweiwertigen Weinsäure frei und der Säuregehalt mit jedem zugesetzten 1 g/L um rd. 1,1 g/L erhöht. Das andere Weinsäuremolekül reagiert mit Calcium zu Calciumtartrat und fällt aus. Kaliumsulfat bzw. -phosphat reichern sich in der Maische bzw. im Most an. Für die Entsäuerung werden in der Praxis Kaliumhydrogencarbonat und Calciumcarbonat (kohlensaurer Kalk) eingesetzt. Bei Ersterem beruht die Wirkung auf Reaktionen des Kaliums mit der Weinsäure, während im Fall von kohlensaurem Kalk das darin enthaltene Calcium gleichfalls mit der Weinsäure reagiert. Der Carbonatanteil der beiden Präparate entweicht bei der Entsäuerung als Kohlenstoffdioxid.
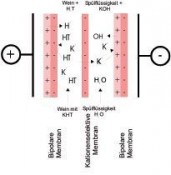
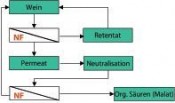
Die chemischen Vorgänge sind in beiden Präparaten gleich und bestehen im ersten Schritt direkt nach der Zugabe des Entsäuerungsmittels aus einer Neutralisation der Säuren zu den entsprechenden Salzen (Kalium- oder Calciumsalze) und anschließend auf einer Ausfällung der gebildeten Salze durch Kristallisation. Da Weinsäure die einzige Säure in Mosten und Weinen ist, die mit beiden Entsäuerungsmitteln unlösliche Salze bildet, hängt der Entsäuerungsspielraum vom ursprünglichen Gehalt der Weinsäure ab. In extremen Jahren, wie es der Jahrgang 2010 regional teilweise war, liegt jedoch eine Mostsäure von rd. 15 g/L und mehr vor, die zu einem Großteil aus der Äpfelsäure besteht. Wird beispielsweise bei einem solchen Gesamtsäuregehalt von rd. 5 g/L Weinsäure ausgegangen und wird zusätzlich berücksichtigt, dass ein Teil der Weinsäure während der Weinbereitung ausfällt und ein abgefüllter Wein einen Weinsäuregehalt von 1–2 g/L aufweisen sollte, kann die Säure maximal um 3 g/L auf etwa 12 g/L vermindert werden; was immer noch als sehr sauer und bei Weitem nicht als harmonisch bezeichnet werden kann. Da diese Moste auch einen ungünstigen, meist zu niedrigen pH-Wert für einen biologischen Säureabbau aufweisen, wurde das so genannte Doppelsalzverfahren entwickelt. Hier wird sich die Tatsache zu Nutze gemacht, dass ein Calcium-Doppelsalz der Wein- und der Äpfelsäure bei pH-Werten über 4,5 stabil ist und ausfällt. Wird nun eine in Abhängigkeit der Gesamtsäuremenge, des Weinsäureanteils und des zu entsäuerten Volumens berechnete Teilmost- bzw. Teilweinmenge mit der für die Gesamtmenge berechneten Calciumcarbonatgabe entsäuert, erhöht sich der pH-Wert in dieser Teilmenge auf über 4,5 und die Doppelsalzkristalle in Form des Calciumtartratmalats fallen aus und können über Sedimentation oder Filtration abgetrennt werden. Die so überentsäuerte Teilmenge wird nach Abtrennung der Kristalle der restlichen Menge wieder zugeführt, sodass sich der gewünschte Säurewert einstellt. Physikalische Möglichkeiten Während die verfahrenstechnischen, biologischen und chemischen Verfahren zu den traditionellen önologischen Verfahren zählen, gehören die physikalischen Verfahren der Säurekorrektur zur neuen Generation und sind größtenteils durch den Gesetzgeber nicht bzw. noch nicht zugelassen. Aufgrund der politischen Bestrebungen, möglichst auf chemische Zusatzstoffe zu verzichten, werden diese in den nächsten Jahren wohl nicht nur im Rahmen eines Säuremanagements an Bedeutung gewinnen. Dies bestätigt die im Jahr 2011 zugelassene Säuerung durch Elektromembranbehandlung. Bei diesem elektrochemischen Verfahren werden durch eine ionenselektive Membran unter Einfluss einer elektrischen Gleichspannung entsprechend elektrische geladene Teilchen, Ionen, aus der jeweiligen Lösung entfernt. Im Falle der Säuerung von Wein werden kationenselektive Membranen verwendet, die vorwiegend für Kaliumionen durchlässig sind. Da in einem elektrischen Feld das Kaliumsalz der Weinsäure, der Weinstein bzw. das Kaliumhydrogentartrat (KHT), in das Kation K+ (Kalium) und das Anion HT– (Hydrogentartrat) zerfällt, kommt es zur Wanderung der Ionen entsprechend ihrer Ladung zur Anode bzw. Kathode. Aufgrund der kationenselektiven Membran kann nun Kalium durch die Membran diffundieren und der Säurerest (HT–) bleibt zurück. Durch die zusätzlich eingesetzten bipolaren Membranen erfolgt ein Ladungsausgleich über Wasserstoffionen (H+), sodass gleichzeitig neben der Säureerhöhung auch der pH-Wert gesenkt wird. Das durch die kationenselektive Membran transportierte Kalium wird vom parallel strömenden Spülkreislauf aufgenommen und reagiert mit Hydroxidionen, die aus einer weiteren bipolaren Membran stammen, zu Kaliumhydroxid (Abb. 3). Werden nun eine anionenselektive anstelle der kationenselektiven Membran verwendet und eine entsprechende Anordnung der Spülflüssigkeit und des Weines gewählt, kann durch das gleiche Verfahren auch entsäuert werden. Hierbei diffundieren die Säurereste u.a. der Wein- und Äpfelsäure durch die anionenselektive Membran. Durch die beiden bipolaren Membranen erfolgt sowohl auf der Spül- als auch der Weinseite der notwendige Ladungsausgleich. Diese Nutzung ist jedoch zur Zeit nicht erlaubt. Neben der Elektrodialyse können auch andere Membranverfahren zur Säurekorrektur von Mosten und Weinen Anwendung finden. Im Falle einer Entsäuerung wird eine so genannte Nanofiltration mit einer Trenngrenze im Bereich der beiden Hauptsäuren Wein- und Äpfelsäure eingesetzt. Diese Trenngrenze beträgt demnach etwa 150 Dalton. Dies bedeutet, dass Moleküle mit einer geringen Molekülmasse durch die Membran diffundieren, größere Moleküle jedoch zurückgehalten werden. Neben den zu entfernenden Säuren sind dies beispielweise Ethanol, Wasser, Essigsäure, aber auch die Milchsäure. In einem zweiten Schritt wird nun der Teilstrom mit den zu entfernenden Säuren über einen Anionenaustauscher geführt. Die Säuren werden zurückgehalten und die anderen Stoffe in die restliche Teilmenge zurückgeleitet, in der nun der Säuregehalt entsprechend absinkt. Anstatt eines Anionentauschers können auch über die Zugabe von Kaliumhydroxid die Säuren neutralisiert werden. In einem weiteren Schritt wird diese neutralisierte Teilmenge über einen weiteren Nanofiltrationsschritt von den entstandenen Salzen der Säuren befreit, die jetzt nicht mehr durch die Membran diffundieren können und in die Restmenge zurück ge führt (Abb. 4). Foto: © Dr. Maximilian Freund |
L&M 5 / 2011
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |