|
Forscher
>
Prof. Dr. Elmar Peschke
>
Eine alte biblische Weisheit von hoher naturwissenschaftlicher Aktualität
Eine alte biblische Weisheit von hoher naturwissenschaftlicher AktualitätEin jegliches hat seine Zeit ...Die Chronobiologie analysiert und beschreibt im Nucleus suprachiasmaticus (master clock) des Zwischenhirns generierte biologische Rhythmen, die unsere Lebensabläufe mittels des Zirbeldrüsenhormons Melatonin synchronisieren. Auch die Insulin- sekretion unterliegt einer tagesperiodischen Rhythmik. Medizinische Bedeutung könnte der jüngst entdeckte Insulin-Melatonin-Antagonismus erlangen, da hohe Melatoninserumspiegel mit niedrigen Insulinkonzentrationen koinzidieren (Typ-1-Diabetes), während niedrige Melatoninspiegel von erhöhten Insulinkonzentrationen begleitet sind (Typ-2-Diabetes). Rhythmen Ein jegliches hat seine Zeit… habe ich meinen Beitrag überschrieben, weil ich zutiefst davon überzeugt bin, dass die meisten, wenn nicht alle biologischen Abläufe periodisch-rhythmisch verlaufen und damit Stabilität erlangen. Wie bei der Blumenuhr von Linné begegnen uns immer wieder rhythmische Abläufe, die von „Inneren Uhren“ gesteuert werden. Die übergeordnete master clock befindet sich im Zwischenhirn, einer paarigen kleinen Neuronenansammlung, dem Nucleus suprachiasmaticus, der periphere Uhren (slave clocks) steuert und bis in den molekularen Bereich wirksam wird. Circadian nennt man freilaufende Rhythmen, die nur unter der Abkopplung von geophysikalischen Einflüssen gemessen werden können und beim Menschen länger als 24h dauern (ca. 24,5h, siehe die genialen Bunkerversuche von Jürgen Aschoff). In aller Regel messen wir jedoch diurnale Rhythmen, weil unsere endogen generierten circadianen Rhythmen, insbesondere unter dem Einfluss des Zeitgebers Licht, mit den bestehenden geophysikalischen Bedingungen synchronisiert werden und damit nicht mehr „freilaufen“. Dass neben den Tagesrhythmen auch kürzere (<20h, ultradiane Rhythmen) sowie längere (>28h, infradiane Rhythmen) wie beispielsweise Lunar- und Jahresrhythmen, anerkannt werden, sei ergänzend hinzugefügt.
wie sie im Jahre 1745 von dem schwedischen Ritter Carl v. Linne – dem „Vater der neuzeitlichen Botanik“ – erfunden und entwickelt wurde, „damit man, wenn man auch bei trübem Wetter auf freiem Felde sich befindet, ebenso genau wissen könne, was die Glocke sei, als wenn man eine Uhr bei sich hätte.“ Gezeichnet von Ursula Schleicher-Benz Lindauer Bilderbogen Nr. 5 Herausgeber Friedrich Boer Jan Thorbecke Verlag Lindau
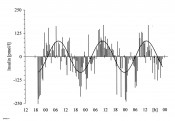
(Einschub: In Kenntnis der Tatsache, dass die biologischen Abläufe periodischen – perpetuierend-wiederkehrenden – Schwankungen im Tages- und Jahresgang unterliegen, sollten Merkmale physiologischer Abläufe über mindestens eine – besser zwei – Perioden gemessen werden. Die punktuelle Erfassung und Beschreibung von Daten hat zurückliegend zu widersprüchlichen wissenschaftlichen Erkenntnissen und im Ergebnis zu viel Unheil in wissenschaftlichen Publikationen geführt). Die Insulinsekretion erfolgt circadian-rhythmisch Erstmalig konnte unter Nutzung perifusiontechnischer Methoden nachgewiesen werden, dass die Insulinsekretion der pankreatischen ß-Zelle auch im In-vitro-Versuch circadian-rhythmisch erfolgt. Ferner wurde aufgrund umfangreicher Experimente deutlich, dass die Rhythmik in der pankreatischen Insel selbst generiert wird, also ein peripherer Oszillator existiert, der neben dem zentralen Schrittmacher Nucleus suprachiasmaticus die rhythmische Insulinsekretion pankreatischer Inseln generiert [1]. Weiterführende Untersuchungen haben ergeben, dass in der Insel nicht nur Uhrengene wie Per1, Per2, Bmal1, Clock, Tim und Cry1 sowie das Output-Gen Dbp exprimiert werden, sondern dass die genannten Genaktivitäten überwiegend circadian-rhythmisch oszillieren [2] und damit für die rhythmische Insulinsekretion verantwortlich sind (Abb. 1).
Abb.1 Beispiel des circadianen Rhythmus der Insulin-Sekretion isolierter Inseln im In-vitro-Perifusionsversuch. Die Periodenlänge (r) betrug bei zehn Versuchen 23,59 ± 0,503h (Mittelwert ± SEM). Generell wurden 30-Minuten-Fraktionen über einen Zeitraum zwischen 44 und 112 h erhoben.
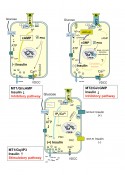
Melatonin senkt die Insulinsekretion rezeptorvermittelt Dass das Hormon der Zirbeldrüse, das Melatonin, von synchronisierender Bedeutung für biologische Abläufe ist und die im Nucleus suprachiasmaticus generierten Rhythmen dem Organismus durch Melatonin vermittelt werden, wurde bereits hervorgehoben. Weiterhin kann festgestellt werden, dass Melatonin die Insulinsekretion senkt, ebenso wie Insulinmangel die Melatoninsekretion erhöht. Bislang konnte in zahlreichen In-vitro- und In-vivo-Versuchen der Antagonismus zwischen Melatonin und Insulin bestätigt werden. In den vergangenen Jahren wurde ferner gesichert, dass die pankreatische ß-Zelle über Melatoninrezeptoren (MT1 und MT2) verfügt und dass die Insulineffekte spezifisch sind [3,4]. Die Nachweise wurden inzwischen sowohl an Ratten-Insulinomazellen INS1, isolierten Ratten-Inseln als auch Pankreasgewebe von Ratte und Mensch validiert. Die Rezeptorergebnisse und Publikationen wurden Ende 2008 unter Zitation unserer Erstbeschreibung in verschiedenen „Nature genetics“-Veröffentlichungen berücksichtigt [5]. Über drei intrazelluläre Signalwege beeinflusst Melatonin die Insulinsekretion Im Ergebnis eigener Untersuchungen konnte der Einfluss von Melatonin auf die pankreatische ß-Zelle und damit auf die Insulinsekretion aufgeklärt werden. Auf Grund perifusiontechnischer, molekularbiologischer, konfokal- und elektronenmikroskopischer sowie immunhistochemischer und radioimmuno- logischer Ergebnisse wurde nachgewiesen, dass Melatonin in der pankreatischen ß-Zelle (Modell: Ratten-Insulinoma-Zelllinie INS1) die cAMP- sowie cGMP-Signalkaskade hemmt und die IP3-Kaskade aktiviert. Beide Effekte werden über membranständige Melatoninrezeptoren (MT1 und MT2) vermittelt (Abb.2).
Abb.2 Grafische Darstellung der beschriebenen drei intrazellulären Signalwege in der pankreatischen ß-Zelle, vermittelt über Guanosin-Triphosphat-Bindungsproteine (G-Proteine). Über den Adenylatzyklase/cAMP- sowie Guanylatzyklase/cGMP-Signalweg hemmt Melatonin die Insulinsekretion, nach Blockierung der inhibitorischen G-Proteine (Gi) mit Pertussistoxin aktiviert Melatonin über den Inositol-Triphosphat (IP3)-Weg die Insulinsekretion.
// 1. Signalweg: Melatonin – MT1/MT2-Rezeptor – Gi-Proteine – Adenylatzyklase – cAMP // 2. Signalweg: Melatonin – MT2-Rezeptor – Gi-Proteine - Guanylatzyklase – cGMP // 3. Signalweg: Melatonin – MT1/MT2-Rezeptor – Gq-Proteine – Phospholipase C – IP3
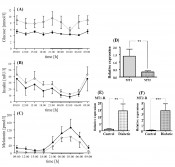
Fazit: Melatonin entfaltet seine intrazellulären hemmenden Effekte auf die Insulinsekretion in der pankreatischen ß-Zelle über den Adenylatcyclase/cAMP- sowie Guanylatcyclase/cGMP-Signalweg (Hauptweg). Unter bestimmten Bedingungen (experimentelle Hemmung von Gi- Insulin-Melatonin-Antagonismen bei Typ-1- und Typ-2-Diabetes Untersuchungen im Tagesverlauf (Datenerfassung alle 3h=8 Erfassungszeitpunkte) haben ergeben, dass – im Vergleich zu metabolisch gesunden Individuen – Typ-2-diabetische Patienten ebenso wie Typ-2-diabetische Goto-Kakizaki(GK)-Ratten durch verringerte Melatoninplasmaspiegel auffällig werden (Abb.3). Mittels molekularbiologischer Techniken (real-time RT-PCR) wurde die tagesrhythmische Expression der MT1-Rezeptor-mRNA im Pankreas, der Arylalkylamin-N-azetyltransferase(AANAT)-mRNA (Schlüsselenzym der Melatoninsynthese) sowie der Insulin-Rezeptor(InsR)-mRNA im Pinealorgan untersucht. Zusätzlich wurde die pineale AANAT-Aktivität im Tagesverlauf bestimmt, die bei den Typ-2-diabetischen GK-Ratten vermindert war. Die AANAT-mRNA hingegen wurde bei erhaltenem Tagesrhythmus vermehrt exprimiert, ebenso wie die Expression der MT1-Rezeptor-mRNA im Pankreas der GK-Ratte erhöht war. GK- und Wistar-Ratten erreichen das Maximum der Expression von AANAT-mRNA sowie MT1-Rezeptor-mRNA in der Mitte der Dunkelzeit. Um nachweisen zu können, an welcher Stelle der Melatoninsynthese bei Typ-2-diabetischen Tieren der Schaden gesetzt wird, wurden jüngst die Melatonin synthetisierenden Enzyme, der pineale Noradrenalingehalt und der pineale Proteingehalt bestimmt. Dabei ergab sich, dass die Epiphysen Typ-2-diabetischer Ratten charakteristische Abweichungen zeigen, die folgendermaßen zusammengefasst werden können: (1) veränderte Aktivitäten der Melatonin synthetisierenden Enzyme, (2) verringerte Vorstufen der Melatoninsynthese und (3) verringerte Noradrenalinspiegel während der Nacht, was die erniedrigte Melatoninsynthese erklären würde. Alle Ergebnisse wurden durch Gewinnung von Tagesprofilen gewonnen, reproduziert und damit validiert.
Abb.3 Tagesrhythmen von Blutglukose (A), Insulin (B) und Melatonin (C) stoffwechselgesunder (durchgezogene Linien) sowie Typ-2-diabetischer Patienten (gepunktete Linien). Typ-2-diabetische Patienten weisen erhöhte Blutglukose- und Insulin- sowie erniedrigte Melatoninwerte auf. Die Insulin- und Melatoninkurven sind bei erhaltener Tagesrhythmik gegenläufig. Die MT1-mRNA- ist gegenüber der MT2-mRNA-Expression erhöht (D). Typ-2-Diabetiker weisen erhöhte Rezeptorexpression sowohl von MT1 als auch MT2 auf (E, F).
In einem weiteren Versuch wurden hohe Mengen von Melatonin normoglykämischen Wistar- und Typ-2-diabetischen GK-Ratten oral verabreicht. Im Ergebnis ließ sich in Ergänzung zu früher durchgeführten In-vitro-Superfusionsexperimenten nachweisen, dass auch im Tierversuch Melatonin die Insulinkonzentration im Blut senkt. Durch diesen Versuch konnten somit die bisherigen In-vitro-Befunde bestätigt werden. Ergänzend wurden Typ-1-diabetische Ratten untersucht, die bei stark erniedrigtem oder fehlendem Insulin nicht erniedrigte, sondern erhöhte Melatonin-Plasmaspiegel aufwiesen, also ebenfalls einen Insulin-Melatonin-Antagonismus zeigten (Streptozotocin-Behandlung bzw. Nutzung spontan Typ-1-diabetischer LEW.1AR1-iddm-Ratten [8, 9]). Nach Insulinsubstitution normalisierten sich nicht nur die Insulin-, sondern auch die Melatoninspiegel in eindrucksvoller Weise (Abb.4).
Abb.4 Tagesrhythmen von Blutglukose (A), Insulin (B) und Melatonin (C) männlicher LEW-Kontrollratten (schwarze durchgezogene Linien), spontandiabetischer Typ-1-iddm-Ratten (rote gestrichelte Linien) sowie mit Insulin substituierter iddm-Ratten (blaue gestrichelte Linien). Die diabetischen Tiere weisen extrem erhöhte Blutglukosewerte auf, die durch Insulinsubstitution erniedrigt werden (A). Die Insulinwerte sind bei den diabetischen Tieren stark erniedrigt (B), die Melatoninplasmaspiegel (C) erhöht. Insulinapplikation normalisiert die Insulin- und Melatoninspiegel bei erhaltener Tagesrhythmik (B,C).
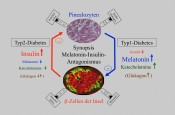
Diese jüngsten Befunde Typ-1- als auch Typ-2-diabetischer Individuen haben in Einheit mit umfangreichen Katecholamin-Bestimmungen (Adrenalin und Noradrenalin) zu der Überzeugung geführt, dass die Katecholamine für das beschriebene antagonistische Verhalten von Insulin und Melatonin verantwortlich zu machen sind. Zusammenfassend kann festgestellt werden, dass Typ-2-Diabetiker erniedrigte Katecholamin- und Melatonin-Spiegel, Typ-1-Diabetiker hingegen stressbedingt erhöhte Katecholamin- sowie Melatoninspiegel aufweisen. Als Erklärung wird angenommen, dass die Katecholamin-Spiegel den Schlüssel für das Verständnis des gegensinnigen Verhaltens von Insulin und Melatonin darstellen, weil die Melatoninsynthese durch Katecholamine entscheidend gesteigert, Insulin hingegen gehemmt wird (Abb.5)[10].
Abb.5 Synopsis des beschriebenen Insulin-Melatonin-Antagonismus. Leicht erhöhte Insulinspiegel Typ-2-diabetischer Ratten und Menschen weisen erniedrigte Melatonin- und Katecholaminwerte auf (linke Seite), während stark erniedrigte Insulinspiegel bei Typ-1-diabetischen Ratten von stark erhöhten Melatonin-, Katecholamin- und Glukagonspiegeln begleitet sind (rechte Seite). Symbole für Katecholamin-, Insulin- und Glukagonrezeptoren auf dem Pinealozyten sowie Katecholamin- und Melatoninrezeptoren auf der pankreatischen ?-Zelle sind eingetragen.
Einfluss von Melatonin auf die Glukagon produzierende pankreatische a-Zelle Im Ergebnis der geschilderten umfangreichen Untersuchungen zum Einfluss von Melatonin auf die Insulinsekretion stellte sich die Frage, ob Melatonin neben seinen Effekten auf die pankreatische ß-Zelle möglicherweise auch Einfluss auf die Glukagonsekretion der a-Zelle nimmt. Inkubationsuntersuchungen an der murinen a-Zelllinie aTC1.9 sowie an isolierten Langerhansschen Inseln der Ratte konnten den Nachweis erbringen, dass Melatonin die Glukagonsekretion stimuliert. Weiterhin konnte unter Einsatz von Melatoninrezeptor-Antagonisten und Melatoninrezeptor-knockout-Mäusen gezeigt werden, dass dieser Effekt ebenfalls über Melatoninrezeptoren mediiert wird, also spezifisch ist. Im Ergebnis der Analyse intrazellulärer Signalkaskaden konnte nachgewiesen werden, dass Melatonin seine Glukagon erhöhende Wirkung über den Gaq-Protein-gekoppelten und den Phosphoinositol-3-Kinase-Signalweg vermittelt. Studien an stoffwechselgesunden Wistar-Ratten zeigten auch in vivo, dass eine nächtliche Melatoninsubstitution für neun Wochen zu einer Erhöhung der Plasma-Glukagonkonzentration führt. Demgegenüber wiesen Typ-2-diabetische Goto-Kakizaki-Ratten keine Veränderungen des Plasmaglukagons nach Melatoninsubstitution auf. Mittels dieser Daten wurde erstmals nachgewiesen, dass Melatonin, rezeptormediiert, stimulierend auf die Glukagonproduktion der pankreatischen a-Zelle wirkt, Effekte, die bei Typ-2-diabetischen GK-Ratten nicht beobachtet werden konnten.
Literatur Bild: © istockphoto.com| MarkSwallow |
L&M 2 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |