|
L&M-4-2012
>
Sinn und Wesen der Blut-Hirn-Schranke
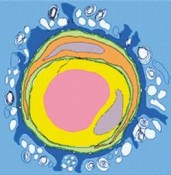
Sinn und Wesen der Blut-Hirn-SchrankeVerschärfter GrenzverkehrWenn man unter Laien der Biomedizin den Begriff „Blut-Hirn-Schranke“ fallen lässt, bekommt man Reaktionen unterschiedlichster Art: Sie reichen von „noch nie gehört“ bis zu der Vorstellung, es müsse sich ja wohl um eine Grenze irgendwo zwischen Herz und Hirn handeln. Selbst unter Neurowissenschaftlern, also Leuten, die sich intensiv um das bessere Verständnis unseres Denkorgans bemühen, ist die Ansicht nicht selten zu finden, Blutgefäße seien entweder im Gehirn nicht vorhanden oder höchstens so bedeutend wie die Wasserleitung im Haus, also um etwas immerhin Wichtiges zu transportieren. Inzwischen aber wird immer klarer, dass die Blutgefäße im Hirn sich von den Blutgefäßen außerhalb des Gehirns unterscheiden, aber nicht, weil die Gefäße unterschiedlich gebaut sind, sondern weil das Gehirn eine enorm komplexe Kontrolle auf die Gefäße ausübt. Die Komplexität dieser Kontrolle wird inzwischen für ähnlich groß gehalten wie die neuronaler Synapsen, um die sich ja bekanntlich das Streben der Neurowissenschaft hauptsächlich bemüht. Und da sind wir auch schon mittendrin in diesem Mikrokosmos aus Gefäßzellen, die man Endothelzellen nennt, und den Zellen, die sich drum herum befinden. Dazu gehören Perizyten, Astrozyten und natürlich Nervenzellen, Neurone (Abb. 1). Astrozyten sind die häufigsten Zellen im Gehirn. Es gibt etwa 100 Milliarden Neurone im menschlichen Gehirn, der sog. Glia-Neuron-Index liegt bei Säugern, abhängig von der Größe und dem phylogenetischen Alter, zwischen 0,1 und 5. Astrozyten stellen den größten Anteil dieser Gliazellen, die man am besten als nervensystemspezifische Nichtnervenzellen bezeichnet. Sie sind außerhalb des Nervensystems nicht zu finden und keine Neurone. Endothelzellen und übrigens auch die gefäßassoziierten Perizyten sind folglich keine Gliazellen, weil sie auch außerhalb des Gehirns vorkommen. Den Komplex aus Endothelzellen, Perizyten, Astrozyten und Neuronen nennt man neurovaskuläre Einheit („neurovascular unit“) und deutet damit eine funktionale Beziehung zwischen diesen Zelltypen an, die in der schon angesprochenen Kontrolle des Gehirns auf die Gefäßeigenschaften besteht [1,2]. Was sind nun die herausragenden Eigenschaften der Hirngefäße?
Die Hirngefäß-Endothelien und nichts anderes bilden den Sitz der Blut-Hirn-Schranke (BHS). Dem berühmten späteren Nobelpreisträger Paul Ehrlich, Begründer der Immunologie, gebührt das Verdienst, im Jahre 1885 „so nebenbei“ die BHS entdeckt zu haben, allerdings mit einer falschen Interpretation seines Experimentes. Er interessierte sich für Farbstoffe und ihre Affinität zu Zellen und Geweben und fand heraus, dass, wenn man Trypanblau in das periphere Blutgefäßsystem injiziert, das Gehirn nicht angefärbt wird. Er deutete dieses erstaunliche Ergebnis mit der Annahme, das Gehirn habe keine Affinität zum Farbstoff. Sein Mitarbeiter Edwin Goldmann machte ein Gegenexperiment und injizierte Trypanblau in den Hirnventrikel und siehe da, das Gehirn und nur dieses färbte sich an. Die Affinitätstheorie war also falsch. Wenn also der Farbstoff von der vaskulären Seite kam, gelangte er nicht in das Hirngewebe (das entsprach der später so genannten Blut-Hirn-Schranke), wenn er von der Seite des Hirnkammerwassers (des sog. Liquors cerebrospinalis) kam, konnte er leicht das Hirn gewebe erreichen (also gibt es keine Liquor-Hirn-Schranke, siehe Abb. 2). Die Hirnkammern, die sogenannten Hirnventrikel, werden von Zellen ausgekleidet, die auch zu den Gliazellen gehören und Ependymzellen genannt werden. Eine verwandte Form dieser Ependymzellen sind die Zellen des Plexus chorioideus, eines Organs, das an verschiedenen Stellen in den Ventrikel hineinragt und für die Bildung des Liquors verantwortlich ist. Die topologischen Verhältnisse sind grob-schematisch in der Abbildung 2 dargestellt [3]. Worin besteht der Sinn der BHS? Er besteht in einem fein abgestimmten Verhältnis zweier Funktionen: dem Schutz des Gehirns vor Schwankungen der Blut-Zusammensetzung und vor neurotoxischen Substanzen einerseits und der gezielten Versorgung des Gehirns mit lebenswichtigen Substraten andererseits. Die BHS muss dafür sorgen, dass sich die Schwankung der Blut-Zusammensetzung nicht auf das Gehirnparenchym, also das Netzwerk der Milliarden und Abermilliarden von Synapsen und Gliafortsätzen, auch Neuropil genannt (Abb. 3), überträgt. In jedem Augenblick ändert sich die Konzentration an Hormonen, Wirkstoffen und Ionen im Blut in Abhängigkeit von der Tageszeit, Nahrungsaufnahme oder anderen stoffwechselphysiologischen Parametern. Die Konzentration von Glutamat im Blut ist, auch ohne chinesische Mahlzeit, 1000-mal höher als im Gehirn, wo Glutamat zwar ein wichtiger erregender Neurotransmitter, aber auch neurotoxisch ist. Das Gehirnparenchym benötigt aber für seine Arbeit ein sehr stabiles Mikromilieu und konstante ionale Bedingungen. Für den Schutz des Gehirns vor ständigen Schwankungen der Blutzusammensetzung und neurotoxischen Einflüssen aus dem Blut kommen nun die wichtigsten Strukturen ins Spiel, die die BHS zu bieten hat, die Tight Junctions (TJs), die letztlich der eigentliche Ort der BHS sind ([4], Abb. 3, 4). TJs sind Zellkontakte, mit deren Hilfe benachbarte Zellen ihren interzellulären Spalt verschließen können. Mittels Elektronenmikroskopie kannte man diese Strukturen in allen Epi- und Endothelien seit den 50er-Jahren des letzten Jahrhunderts, aber die Aufklärung der molekularen Zusammensetzung der TJs war erst den 90er- Jahren vorbehalten, hauptsächlich durch hier der Glukose-Transporter, dessen Expression geradezu als Parameter der BHS gilt. Im Folgenden wollen wir uns der Frage zuwenden, wie die perivaskuläre Umgebung der Hirnkapillaren strukturiert ist und unter pathologischen Bedingungen verändert wird. Der subendotheliale oder perivaskuläre Raum
Zunächst einmal fällt auf, dass die Blutkapillaren im Gehirn – im Gegensatz zu allen anderen Kapillaren außerhalb des Gehirns (mit Ausnahme der Lunge) – extrem eng in das umgebende Gewebe integriert sind (Abb. 3, 4A). Unterhalb jeder Endothelzelle liegt eine Basallamina, also eine etwa 30–80 Nanometer (millionstel Millimeter) dicke Schicht aus extrazellulärer Substanz oder Matrix. Direkt an diese Basallamina grenzen die beiden subendothelialen Zelltypen, die Perizyten und die Astrozyten. Die Perizyten sind komplett in eine Basallamina eingebettet, die Astrozyten bilden Fortsätze und kontaktieren mit ihren perivaskulären wie auch superfiziellen (an der Hirnoberfläche gelegenen) „Endfüßen“ die Basallamina. An dieser Kontaktstelle enthalten die Astrozytenmembranen Kalium- und Wasserkanäle in extrem hoher Dichte [8]. Wo sich die Astrozytenmembran vom Kontakt mit der Basallamina abwendet, fällt diese Dichte an den Kanälen drastisch ab. Dieser Dichteunterschied der Kanäle begründet eine Polarität der Astroglia, deren physiologische Bedeutung wir noch kennen lernen werden. Bevor man wusste, dass es sich um Wasserkanäle handelt, kannte man schon die entsprechende elektronenmikroskopische Struktur, die man als „orthogonale Partikelkomplexe“ (OPKs) bezeichnete ([9, 10], Abb. 5). Am Astrozytenendfuß, also an der Stelle, an der die Membran die Basallamina kontaktiert, sind die OPKs mit einer Dichte von über 400/?m² vorhanden, während an den parenchymalen Astrozytenmembranen die OPK-Dichte nur etwa 20–40/?m² beträgt. In den Jahren 1986 und 1988 entdeckten der Rumäne Gheorghe Benga und der Amerikaner Peter Agre die Wasserkanäle (Aquaporine), die praktisch ubiquitär in allen Zellen vorkommen. Später wurde bekannt, dass eine besondere Isoform, das Aquaporin-4 (AQP4), im ZNS charakteristisch für Astrozyten ist und dass die an den Endfüßen besonders hoch konzentrierten OPKs mindestens aus AQP4 bestehen. Peter Agre erhielt übrigens für die Entdeckung der Aquaporine 2003 den Nobelpreis für Chemie. Wie gesagt, zwischen Endothelzelle und Astrozyt liegt die Basallamina (BL in Abb. 2, 4A). Diese besteht aus zahlreichen hochmolekularen Substanzen wie Glykosaminoglykanen, Kollagenen, Laminin, Fibronektin und auch aus einem Protein, das in ganz anderem Zusammenhang schon bekannt war, nämlich aus Agrin. Agrin sorgt in der Muskulatur dafür, dass die Acetylcholinrezeptoren in der motorischen Endplatte nur dort aggregieren [sic!], wo sie gebraucht werden, nämlich da, wo das Acetylcholin ausgeschüttet wird. Im ZNS werden nun spezielle Agrin-Isoformen aus Endothelzellen und Astrozyten ausgeschüttet und bewirken, dass das AQP4 geclustert wird wie im Muskel der Acetylcholinrezeptor: In einem OPK werden bis zu 100 AQP4-Tetramere vereint. Allerdings bindet Agrin nicht direkt an AQP4, sondern an das sog. Dystroglykan, das über eine molekulare Brücke mit AQP4 in Verbindung steht (Abb. 6). In Abwesenheit von Agrin kann AQP4 nicht hinreichend geclustert werden und die OPKs bleiben nicht auf die Endfußmembran beschränkt, sondern verteilen sich über die ganze Zelle [11]. Tatsächlich konnte dies z.B. im Hirntumor gezeigt werden, wo Agrin fehlt und AQP4 umverteilt wird (Abb. 7, [12]). Interessanterweise geht nun mit der Umverteilung von AQP4 auf der glialen Seite, also einer Reduktion der Gliapolarität, eine Erhöhung der Permeabilität auf der endothelialen Seite einher. Diese Beziehung berührt sozusagen die „Millionen-Dollar-Frage der Blut-Hirn-Schranken-Forschung“: Wer oder was bedingt die komplexe TJ-Struktur (niedrige Permeabilität) und die hohe Polarität der Gliazelle und wie sind beide miteinander verknüpft? Abbildung 8 versucht eine Illustration dieser Frage. Die Veränderung der AQP4-Lokalisation im Astrozyten hat nun dramatische pathophysiologische Konsequenzen (Abb. 9): In synaptischen Bereichen des Gehirngewebes wird Kalium ausgeschüttet. Die extrazelluläre Kaliumkonzentration muss sehr schnell wieder normalisiert werden, um die Neurone wieder erregungsfähig zu machen. Diese Normalisierung geschieht durch die Astrozyten, die Kalium sehr effektiv aufnehmen. Die Folge ist osmotisch bedingter Wassereintritt in die Zelle, dem aber entgegengewirkt werden muss, um die Zellen nicht zum Platzen zu bringen. Das Wasser und auch das Kalium verlassen die Zelle wieder, wo entfernt von Synapsen eine extreme Kalium- und Wasserkanaldichte herrschen. Das ist an den schon beschriebenen Endfußbereichen der Fall und wird durch die Anwesenheit von Agrin in der Basallamina ermöglicht. Wenn dieses nun wegfällt, kommt das ganze austarierte System der Ionen- und Wasserkontrolle aus dem Gleichgewicht, weil die Wasserkanäle jetzt an „verbotenen“ Stellen sitzen und es kommt zum sog. zytotoxischen Ödem, dem der Zusammenbruch der BHS folgt und diesem das vasogene Ödem. Das Ödem beim schlimmsten aller Hirntumore, dem Glioblastom, ist das am meisten gefürchtete Symptom, weil es enormen Hirndruck erzeugt und auch eigentlich gesunde Hirnbereiche in Mitleidenschaft gezogen werden. Ausblick Obwohl es wegen des beschränkten Raumes nicht möglich war, die Komplexität der neurovaskulären Einheit in allen Aspekten darzustellen, ist vielleicht sichtbar geworden, dass die Hirngefäße alles andere als Strukturen sind, die mit einer Wasserleitung vergleichbar wären. Das Endothel gleicht einem janusköpfigen Wesen, das sowohl zum Blut blickt – und sich ständig mit den wechselnden Konzentrationen zahlloser Blutstoffe auseinandersetzen muss – als auch zum Gehirn schaut und barriereförderliche Signale aus dem neuralen Parenchym empfängt, um den Anforderungen einer dynamischen Anpassung an neurophysiologische und metabolische Notwendigkeiten gerecht zu werden. Die BHS ist keine starre Barriere, sie passt sich an und ist so fein reguliert (durch Expression von multiplen Claudinen und Transportern einerseits und die Anwesenheit verschiedenster extrazellulärer Matrix- Komponenten und perivaskulärer Zellen andererseits), dass die Möglichkeit denkbar erscheint, dass die BHS geringste Lecks, die aber weit unter der Nachweisgrenze klinischer Bildgebung liegen, nicht nur duldet, sondern sogar aktiv ermöglicht und dadurch neurotropen Substanzen Zutritt zum ZNS erlaubt, die ihrerseits neuronale Schaltkreise beeinflussen könnten. Dies würde eine Art „vaskuläre Neurobiologie“ begründen und die Komplexität und Plastizität des Gehirns noch einmal ins Unermessliche steigern. Um alle Abbildungen zu sehen, laden Sie bitte das PDF (rechts oben) runter.
Literatur Foto: © Prof. Dr. Hartwig Wolburg |
L&M 4 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |