|
Stabile Diaminocarbene aktivieren kleine Moleküle
Stabile Diaminocarbene aktivieren kleine MoleküleBeflügelte Arbeitspferde!Stabile Diaminocarbene: Ihre Entdeckung 1991 war eine Sen sation. Mittlerweile sind sie nicht mehr wegzudenken aus der Chemie, sind Arbeitspferde für Synthese und Katalyse. Ihre Eigenschaften: äußerst nützlich, aber nach gängiger Ein schätzung eher unspektakulär. Stimmt nicht ganz! Neueste Erkenntnisse zeigen: Man hat sie deutlich unterschätzt. Offenbar gibt es Arbeits pferde mit Flügeln. Kohlenstoff steht in der 2. Periode und ist dort das Kopfelement der 4. Hauptgruppe. Ein C-Atom verfügt über vier Valenzorbitale und vier Valenzelektronen. Daher ist Kohlenstoff in der Regel vierbindig und vierwertig. Verbindungen des zweiwertigen Kohlenstoffs – die Carbene (X-C-Y) – sind naturgemäß hoch reaktiv. Die Substituenten X und Y bestimmen, wie die beiden nicht verwendeten Valenzelektronen des C-Atoms auf die beiden nicht an der Bindung von X und Y beteiligten Orbitale verteilt sind. In den meisten Fällen besetzen beide Elektronen unter Spinpaarung gemeinsam eins der beiden Orbitale. Dieses ist dann das höchste besetzte Molekülorbital (engl. highest occupied molecular orbital, HOMO). Das verbleibende, senkrecht zu diesem einsamen Elektronenpaar orientierte p-artige Valenzorbital ist das niedrigste unbesetzte Molekülorbital (engl. lowest unoccupied molecular orbital, LUMO). Die Energie dieser Frontorbitale bestimmt wesentlich die Reaktivität derartiger Singulett-Carbene. Prinzipiell können diese sowohl nucleophile als auch elektrophile Eigenschaften aufweisen. Für die Nucleophilie ist das einsame Elektronenpaar am divalenten C-Atom verantwortlich. Je höher die HOMO-Energie, desto nucleophiler. Die Elektrophilie hängt natürlich mit dem unbesetzten Valenzorbital (LUMO) zusammen. Stabile Carbene: Sensation mit Gewöhnungseffekt
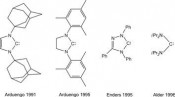
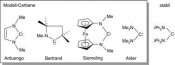
Lange Zeit hielt man es für unmöglich, Carbene in Substanz zu isolieren. Dieses Paradigma wurde 1991 schlagartig umgestoßen, als Arduengo und Mitarbeiter über die Synthese und Isolierung eines „stabilen, kristallinen Carbens“ (so der Titel der Publikation) berichteten [1]. Es handelte sich dabei um 1,3-Di-1-adamantylimidazol- 2-yliden (Abb. 1), ein N-heterocyclisches Carben (NHC), dessen divalentes C-Atom durch zwei Aminosubstituenten stabilisiert wird. Markantes Merkmal solcher NHCs ist ihre Nucleophilie. Aminogruppen und ähnliche Substituenten mit mesomeriefähigen einsamen Elektronenpaaren
können nämlich die Elektronenlücke (LUMO) am divalenten C-Atom teilweise füllen, indem sie p-Elektronendichte dorthin donieren und die Elektrophilie des Carbens somit abmildern. Es stellte sich bald heraus, dass neben diesen imidazolbasierten „Arduengo-Carbenen“ eine Reihe weiterer NHCs isolierbar ist, die sich von anderen Fünfring-N-Heterocyclen ableiten (z. B. von 1,3-Imidazolin [2] und 1,2,4-Triazol [3], Abb. 2) und dass auch größere [4] oder kleinere N-Heterocyclen [5] Pate stehen können. Sogar die Isolierung eines acyclischen Diaminocarbens, nämlich iPr2N-C-NiPr2 (Abb. 2), gelang bereits 1996 durch Alder und Mitarbeiter [6]. Aktivierung kleiner Moleküle: eine Herausforderung Kleine Moleküle wie H2, NH3 und CO sind Grundbausteine in der chemischen Industrie. Ihre Aktivierung ist von elementarer Bedeutung und dies unter milden Bedingungen zu schaffen, eine der Herausforderungen der modernen Chemie. Die Schwierigkeit liegt darin, dass sie durch starke und wenig polare kovalente Bindungen zusammengehalten werden. Traditionell ist die Aktivierung kleiner Moleküle eine Domäne der Übergangsmetallchemie [11]. Die Einschätzung, dass Hauptgruppenelement-Verbindungen für diese Aufgabe generell ungeeignet sind, wurde 2005 von Power und Mitarbeitern widerlegt [12]. Sie berichteten über die erste unter milden Bedingungen ablaufende unkatalysierte Reaktion von H2 mit einer stabilen Hauptgruppenelement-Verbindung, nämlich dem Alkin-Analogon des Germaniums RGeGeR [R = C6H3-2,6- (C6H3-2,6-iPr2)2]. Seitdem wurden etliche weitere Beispiele für die Aktivierung von H2, NH3, CO und anderen kleinen Molekülen mit niedervalenten und niederkoordinierten Verbindungen der schwereren Hautgruppenelemente bekannt [13]. Aktuell erwächst daraus ein neues Konzept, das unter der Überschrift „Hauptgruppenelemente als Übergangsmetalle“ gehandelt wird [14]. Diese faszinierende Entwicklung geschieht vor allem in der Chemie der kohlenstoffhomologen Elemente Silicium, Germanium und Zinn. Im Vergleich zu ihren schwereren Homologen weisen die Kopfelemente der Hauptgruppen naturgemäß deutlich kleinere Atome auf. Für Kohlenstoff bedeutet dies im Vergleich zu Silicium und Co. kürzere und stärkere Bindungen und damit vergleichsweise große Energiedifferenzen zwischen HOMO und LUMO. Daher ist in der Kohlenstoffchemie die übergangsmetallartige Reaktivität, die für seine niedervalenten schwereren Homologen seit 2005 etabliert wurde, kaum zu erwarten. Ausnahmeathleten sind ambiphil
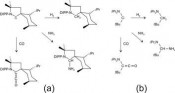
Es war eine Sensation, als Bertrand und Mitarbeiter zeigten, dass bestimmte stabile Verbindungen des zweiwertigen Kohlenstoffs tatsächlich doch in der Lage sind, H2, NH3 und CO unter milden Bedingungen in unkatalysierten Reaktionen zu addieren (Abb. 3) [15]. Bei diesen Ausnahmeathleten handelt es sich um (Alkyl)(amino) carbene des Typs R-C-NR’2. Wie ist deren spektakuläre, übergangsmetallartige Reaktivität zu erklären? Weisen sie etwa die
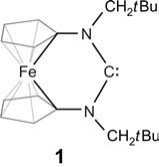
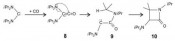
übergangsmetalltypische Konstellation eines energiereichen besetzten und eines relativ energiearmen unbesetzten Orbitals an einem valenzmäßig ungesättigten Atom auf? Tatsächlich ist das so! Erinnern wir uns noch einmal an die „Arduengo-Carbene“ – sehr nucleophil, aber wegen der beiden Aminosubstituenten, die die Elektronenlücke am divalenten C-Atom durch ?-Elektronendonation füllen können, wenig elektrophil. Bei den (Alkyl)(amino)carbenen R-C-NR’2 ist das anders: Hier ist nur ein einziger Aminosubstituent im Spiel. Dadurch sind sie nicht nur nucleophil, sondern auch deutlich elektrophil. Das gemeinsame Auftreten von Nucleophilie und Elektrophilie heißt Ambiphilie. Sie ist das Geheimnis der Reaktivität gegenüber kleinen Molekülen. Diese hohe Reaktivität bedeutet zugleich, dass es außerordentlich schwierig ist, (Alkyl) (amino)carbene so zu zähmen, dass man sie in Substanz isolieren kann. Das ist bisher nur in ganz wenigen Fällen gelungen, mit perfekt maßgeschneiderten Resten R und R’. Vor dem Hintergrund der fantastischen Reaktivität der (Alkyl) (amino)carbene erscheint die gewohnte Reaktivität von „Arduengo- „Arduengo-Carbene“ sind anders Um das Reaktionsverhalten unseres NHCs besser verstehen zu können, haben wir theoretische Untersuchungen mithilfe quantenchemischer Rechnungen durchgeführt [18, 19]. Dabei wurden cyclische Modellcarbene vom Arduengo-, Bertrand- und Siemeling-Typ betrachtet sowie ein Modellcarben des acyclischen Alder-Typs; zusätzlich wurde das „Alder-Carben“ (iPr2N)2C als einfachstes stabiles Diaminocarben mit einbezogen (Abb. 6). Die Ergebnisse zeigten eindeutig, dass Carbene vom Arduengo-Typ elektronisch völlig anders sind als die der anderen Typen. Markantes Merkmal der „Arduengo-Carbene“ ist ja ihre Nucleophilie. Hingegen stellten sich Carbene der anderen Typen allesamt als ambiphil heraus. Es ist somit nicht weiter verwunderlich, dass 1 eine für (Alkyl)(amino) carbene typische Reaktivität zeigt. Unsere Ergebnisse sagten voraus, dass auch das stabile „Alder-Carben“ (iPr2N)2C für die Aktivierung kleiner Moleküle tauglich sein sollte und trotz anders lautenden Behauptungen [15] sogar mit CO reagieren müsste. Das bewahrheitete sich: Bereits unter sehr milden Bedingungen findet eine Umsetzung statt. Dabei entsteht ganz glatt das beta - Lactam-Derivat 10 [18]. Quantenchemische Rechnungen legen für diese verblüffende Reaktion den in Abb. 7 gezeigten Ablauf nahe. Wie bei der Umsetzung von 1 mit CO (Abb. 5) wird auch hier im Primärschritt durch Carbonylierung des Diaminocarbens ein hoch reaktives Diaminoketen (8) gebildet. Dieses unterliegt einem intramolekularen nucleophilen Angriff, der zu dem neuen Carben iPr2N-C-C(O)NiPr2 (9) führt, das einen Elektronen schiebenden Amino- und einen elektronenziehenden Carboxamido-Substituenten besitzt. Diese „push-pull“-Konstellation ist prädestiniert für die Aktivierung unpolarer C-H-Bindungen. Genau das geschieht im letzten Schritt der Reaktionssequenz, wo eine intramolekulare Insertion in eine Me2C-HBindung stattfindet. Somit führt uns die Reaktionssequenz von einem Carben über ein Keten zu einem neuen Carben und schließlich zu einem beta-Lactam. Dreiklang mit Tradition: Carbene, Ketene, beta-Lactame
Schon seit einem Jahrhundert ist die Chemie von Carbenen, Ketenen und beta -Lactamen eng miteinander verflochten. 1913 beschrieb Staudinger die thermische Decarbonylierung von Ketenen und die Folgereaktionen der
resultierenden hoch reaktiven Carbene [20]. Etwas früher hatte er bereits beobachtet, dass Ketene und Imine miteinander zu beta -Lactamen reagieren [21]. Das ist heutzutage als Staudinger-Reaktion geläufig und stellt den wichtigsten Zugangzu diesem besonders prominenten Ringsystem dar. Lactame bilden eine medizinisch- Fazit Allen Unkenrufen zum Trotz kann die Aktivierung kleiner Moleküle sowohl mit cyclischen als auch mit acyclischen Diaminocarbenen gelingen. Auch und gerade die lange unerkannte Reaktivität des einfachsten stabilen Diaminocarbens, (iPr2N)2C, unterstreicht nachdrücklich, dass Diaminocarbene in puncto Reaktivität und Synthesepotenzial deutlich unterschätzt wurden. Und wo wir schon mal dabei sind: Beim „Alder-Carben“ haben wir gerade mit einem weiteren fatalen Vorurteil aufgeräumt [22]. Lassen Sie sich überraschen! Literatur beim Autor Foto: © Prof. Dr. Ulrich Siemeling |
L&M 4 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |