|
Wissenschaft
 >
Biolumineszenz in Natur und Forschung
>
Biolumineszenz in Natur und Forschung
Biolumineszenz in Natur und ForschungWie ein falscher Wurm Licht ins Dunkel brachteAnlocken oder Abschrecken? Tarnen oder Kommunizieren? In der Luft, auf dem Boden und in den Tiefen des Meeres nutzen Organismen die Biolumineszenz. Dank des „Glühwürmchens“ bringt das Naturphänomen seit fast 30 Jahren auch Licht in das Dunkel der ungeklärten Fragen der Biowissenschaften. Ab Juni ist es wieder soweit: Sobald die Nacht anbricht, verwandeln sich fast überall auf der Welt Gärten, Wälder und Wiesen in ein funkelnd-leuchtendes Spektakel, das sich einer großen Fangemeinde erfreut. Selbst Dichter und Sänger sind fasziniert von einem Insekt, das bei Tageslicht vermutlich nicht allen Beobachtern einen ähnlich entzückten Ausdruck aufs Gesicht zaubern würde. Doch der im Volksmund als „Glühwürmchen“ bezeichnete Leuchtkäfer ist nicht allein. Denn neben dem wohl populärsten Vertreter an Land nutzen viele Meeresbewohner, aber auch Pilze, Einzeller und Bakterien die Biolumineszenz für unterschiedliche Zwecke. Das Anwendungsspektrum reicht dabei von der Partnersuche und Kommunikation bis hin zur Tarnung und Abschreckung von Fressfeinden. Worin liegt das Geheimnis der Biolumineszenz? Unterschiedliche evolutionäre Hintergründe führten zu verschiedenen Biolumineszenzklassen, die sich in ihren chemischen Eigenschaften unterscheiden. Einige Organismen, darunter der Leuchtkäfer, verwenden spezielle, artspezifische Luciferasen, die mithilfe von molekularem Sauerstoff ein luminogenes Substrat in einer chemischen Reaktion unter Lichtaussendung umsetzen. Der Leuchtkäfer nutzt dafür die Firefly-Luciferase, um das Substrat Luciferin zu Oxyluciferin zu oxidieren. Manche Meeresbewohner wie z.B. die Seefedernart Renilla reniformis legen noch eine Schippe drauf. Für das typisch grüne Leuchten der Seefeder ist nämlich ein zweistufiger Mechanismus verantwortlich. Dafür setzt die Renilla-Luciferase zuerst das Substrat Coelenterazin zu Coelenteramid um. Das dabei emittierte blaue Licht wird dann vom grün fluoreszierenden Protein (GFP) absorbiert, welches in Folge grünes Licht emittiert. Dieser physikalische Prozess ist unter dem Begriff Biolumineszenz-Resonanzenergietransfer (BRET) bekannt (s. Infobox).
Abb.1 Chemische Reaktion der Firefly- und Renilla-Luciferase mit den entsprechenden Substraten. Anders als die Firefly-Luciferase verbraucht die Renilla-Luciferase kein ATP bei der Katalyse.
Von der Natur auf die Laborbank Der Biochemiker Dr. Keith Wood war einer der ersten, der das Potenzial der Biolumineszenz als Reportermolekül erkannte und 1985 an der University of California mit der Expression rekombinanter Firefly-Luciferasen begann [1]. Fragt man Wood, wie er auf den Pfad der Erleuchtung gelangte, erklärt er: „Als ich in das Forschungsfeld Biolumineszenz einstieg, war gerade eine spannende Zeit für die Untersuchung von Enzymmechanismen. Die Biochemie wurde bis dahin von klassischen Techniken der Enzymkinetik dominiert, indem man Proteine nutzte, die aus natürlichen Quellen aufgereinigt wurden. Ich wusste bereits zu Highschool-Zeiten, dass ich die Möglichkeit haben wollte, Grundbausteine biologischer Moleküle, vor allem Proteine, zu nehmen und diese Grundbausteine neu anzuordnen.“ Bereits ein Jahr später stellte Woods Forscherteam die bemerkenswerten Fähigkeiten des klonierten Luciferasegens der Öffentlichkeit in Form einer lumineszierenden Tabakpflanze vor [2]. Mitte der neunziger Jahre erschienen die ersten kommerziell erhältlichen Produkte, die auch noch heute größtenteils auf Firefly- und Renilla-Luciferasen basieren.
Abb.2 Lumineszierende transgene Tabakpflanze. Die Abbildung repräsentiert das erste Foto eines transgenen multizellulären Organismus, der durch das Einbringen des Firefly-Luciferasegens Lumineszenz erzeugen kann [2]. Heutzutage ist das biolumineszenzbasierte Imaging in lebenden Pflanzen und Tieren ein wichtiges Werkzeug in den Biowissenschaften.
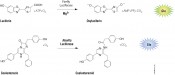
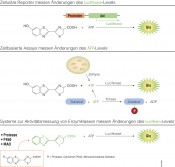
Anwendung der Biolumineszenz in den Biowissenschaften Biolumineszente Methoden werden in den Biowissenschaften überwiegend in der Grundlagenforschung und Entwicklung eingesetzt. Die Luciferasereporter eignen sich dabei für verschiedene Fragestellungen. Als genetische Reporter werden sie häufig für die Untersuchung der Genregulation oder Analyse zellulärer Signalwege genutzt; als Proteinfusionsreporter eignen sie sich für die Analyse von Proteininteraktionen und Proteinstabilität. Doch damit nicht genug. Modifiziert man die Luciferasereaktion, lässt sie sich als Nachweis- und Quantifizierungsmethode für Zellzustände wie Zellviabilität, Nekrose und Apoptose nutzen. Über den ATP-Gehalt kann man beispielsweise die Stoffwechselaktivität bzw. Viabilität von Zellen analysieren. Eine Methode, die auch in der Umweltanalytik genutzt wird, um z.B. Bakterien auf Oberflächen nachzuweisen. Ergänzt man das Substrat (z.B. Luciferin) durch eine funktionelle Gruppe, erhält man ein System zur Aktivitätsmessung verschiedener Enzymklassen in biochemischen und zellulären Testsystemen (Abb. 3).
Abb.3 Verschiedene Biolumineszenzanwendungen basierend auf der Firefly-Luciferase-Reaktion. Durch leichte Modifikationen der Firefly-Luciferase-Reaktion können unterschiedliche biochemische und zellbasierte Assays für die Analyse der Genregulation, von Zellzuständen und Enzymaktivitäten aufgebaut werden.
Kleiner, heller, stabiler – Weiterentwicklung der Technologie Das vielfältige Anwendungsspektrum und eine zunehmende Beliebtheit im Labor haben Wissenschaftler motiviert, nach alternativen Luciferasen zu suchen. Dabei machen sie sich vor allem in der Tiefsee auf die Suche, einem Ort, an dem bis zu 90% der Organismen die Lumineszenz für verschiedene Zwecke nutzen. Mary Halls Arbeitsgruppe war besonders von der Tiefseekrabbe Oplophorus gracilirostris angetan [4]. Die Krabbe sekretiert ihre Luciferase in hell leuchtenden Wolken, um damit Fressfeinde abzuwehren. Im Vergleich zu anderen untersuchten Organismen, produzierte sie ein langanhaltendes, helles Lichtsignal und wurde somit zum Favoriten der Biolumineszenzforscher. Die Arbeitsgruppe fand heraus, dass, obwohl das Protein eine heteromere Struktur aus zwei 35?kDa und zwei 19?kDa Untereinheiten besitzt, die Biolumineszenzaktivität auf eine der kleinen Untereinheiten zurückzuführen ist. Also unternahm man mehrere Optimierungsschritte (gerichtete Evolution), die letztlich zu einer stabilen Luciferase mit dem Namen NanoLuc (NLuc) und dem coelenterazinanalogen Substrat Furimazin führten. Die neu geschaffene rekombinante Luciferase verursacht dank ihrer geringen Größe kaum unerwünschte Wechselwirkungen in der Zelle und ist im Vergleich zur Firefly-Luciferase toleranter gegenüber Temperaturschwankungen, pH-Unterschieden und denaturierenden Reagenzien. Kombiniert mit dem Substrat Furimazin, das eine höhere Lichtausbeute als Coelenterazin erzielt und eine geringere Autolumineszenz aufweist, eignet sich die NanoLuc-Luciferase als hochsensitiver Reporter, mit dem u.a. das Arbeiten unter physiologischen Bedingungen und bei endogenen Expressionsleveln ermöglicht wird. Samuel Hasson, Pharmakologe am National Institute of Neurological Disease and Stroke, nutzt die Luciferase für seine Parkinsonforschung [5]. Er selbst sagt, dass es ohne die geringe Größe und hohe Helligkeit der NanoLuc-Luciferase nicht möglich wäre, In-vitro-Studien zur Rolle der mitochondrialen Dysfunktion bei der Parkinsonkrankheit durchzuführen. Besonders bei geringer Genexpression sei das Signal deutlich höher als mit der Firefly-Luciferase. Vor allem aber störe man den natürlichen Prozess weniger, wenn man das mitochondriale Protein mit einem kleineren Reporter markiere.
Abb.4 BRET-Technologie im Labor. [A] Proteininteraktionspartner (X;Y) werden in Zellen exprimiert. Der Energietransfer auf das Fluorophor findet nur dann statt, wenn Protein X und Protein Y einen Abstand von < 10 nm besitzen. [B] Für Chemoproteomics/Target Engagement wird das Proteintarget X als NanoLuc-Fusionsprotein exprimiert und der fluoreszierende Ligand chemisch an das „small molecule“ gekoppelt.
Früher, heute und morgen Was mit dem Leuchtkäfer und einer lumineszierenden Tabakpflanze begann, hat sich innerhalb von 30 Jahren zu einer etablierten Technik in der Bioanalytik entwickelt. Ob als zellulärer Reporter, Nachweis- und Quantifizierungsmethode für zelluläre Zustände oder als System zur Aktivitätsmessung verschiedener Enzymklassen: Wie in der Natur hat die Biolumineszenz auch im Labor vielfältige Einsatzmöglichkeiten. Doch das enorme Potenzial ist noch nicht ausgeschöpft. Eine vielversprechende Entwicklung durchläuft die Biolumineszenz beim Imaging von Pflanzen und Tieren. Und zwar besonders dort, wo fluoreszente Methoden an ihre Grenzen stoßen. Die Einbringung des GFP-Gens in Mäuse und andere Labortiere ermöglicht es uns bereits seit einigen Jahren, Proteinbewegungen und Aktivitäten zu verfolgen. Doch die Technik hat auch ihre Schwächen: Das Licht, das zur Anregung fluoreszierender Moleküle wie GFP genutzt wird, dringt nicht tief ins Gewebe ein. Erhöht man die Energie der eingebrachten Photonen, steigt automatisch auch das Hintergrundrauschen und die Signalqualität nimmt ab. Dies führt dazu, dass Wissenschaftler ihre Untersuchungen häufig nicht an lebenden Tieren durchführen können. Hier liegt die Stärke der Biolumineszenz. Sie muss nicht erst durch eine externe Photonenquelle angeregt werden und verursacht dadurch nahezu kein Hintergrundrauschen. So können Prozesse wie Tumorwachstum mithilfe von sensitiven Kameras in vivo beobachtet werden [6]. Mit zunehmender Kamerasensitivität und neuen, noch lichtintensiveren Substraten kann die Biolumineszenz in der Zukunft so eine wichtige Rolle im Live-Imaging von Krebszellen, Infektionserregern oder Immunzellen spielen. Aber auch außerhalb des Labors, z.B. in der Medizin, könnte die Biolumineszenz an Bedeutung gewinnen. Lichtgeleitete Operationen, um das Durchtrennen leuchtender Nerven zu vermeiden, oder eine vollständigere Entfernung von Tumoren sind nur zwei denkbare Anwendungen.
Literatur Foto: © istockphoto.com| Fernando Gregory |
L&M 5 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |