|
L&M-4-2012
>
Katalyse völlig neuartiger organischer Transformationen durch lösliche Goldkomplexe
Katalyse völlig neuartiger organischer Transformationen durch lösliche GoldkomplexeGold macht’s möglichErst kürzlich haben Goldkatalysatoren einen festen Platz im Arsenal der Katalyseforscher erhalten. Neben einer einzigartigen Aktivität zeichnen sie sich auch durch hochinteressante Intermediate im Katalysezyklus aus. Neben Vinylgoldverbindungen können sogar Gold-Carbenoide oder, wie jüngst gezeigt, Gold-Vinylidenverbindungen durchlaufen werden. Letztere sind sogar in der Lage, unaktivierte C-H-Bindungen in Alkylseitenketten, also notorisch unreaktive Gruppen, zur Reaktion zu bringen.
Seit prähistorischen Zeiten von Menschen hoch geschätzt, wurde Gold im Bereich der Katalyseforschung erst kürzlich eine ähnliche Aufmerksamkeit zuteil. Zwar gab es im Bereich der heterogenen Katalyse durch unlösliche Katalysatoren erste zaghafte Versuche schon 1973 durch Geoffrey Bond [1], doch erst 1986 wurde von Ito und Mitarbeitern über die erste wichtige Anwendung im Bereich der Homogenkatalyse berichtet [2]. Katalyse hat eine zentrale Bedeutung im Bereich der chemischen Produktion, mehr als 90 % aller industriell hergestellten Verbindungen durchlaufen bei ihrer Synthese zumindest eine, wenn nicht mehrere Katalysereaktionen. Diese immense Bedeutung der Katalyse wird z.B. dadurch dokumentiert, dass vier Chemienobelpreise der letzten Dekade an Katalyseforscher vergeben wurden. Die Katalysatoren
Bei den Katalysatoren handelt es sich um Komplexe des Goldes. Beide der stabilen Oxidationsstufen von Gold, Gold(I) und Gold(III), werden eingesetzt. Gold(I) weist eine lineare Koordinationsgeometrie auf, zwei Liganden sind auf den gegenüberliegenden Seiten des Goldkations gebunden. Die Synthese dieser Katalysatoren ist einfach. Um Kosten zu sparen, kann man hier sogar von einem kleinen in der Bank erworbenen Goldbarren ausgehen, den man zunächst in Königswasser (eine Mischung von Salpetersäure und Salzsäure) auflöst. Dieses als „klassisch“ zu betrachtende Vorgehen liefert eine Lösung von Tetrachlorgoldsäure (HAuCl4, eine Gold(III)- Nukleophile Additionen – ein Eldorado der Heterozyklen
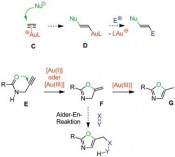
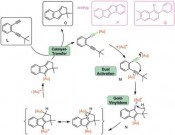
Während polarisierte Mehrfachbindungen, z.B. in C=O-Doppelbindungen, bereitwillig mit Nucleophilen reagieren, ist dies bei nicht aktivierten C=C-Doppelbindungen oder C==C-Dreifachbindungen nicht der Fall. Hier sind die Goldkatalysatoren als weiche, carbophile Lewis-Säuren ideale Aktivatoren. Durch Koordination an den elektrophilen Goldkatalysator wird die C- C-Mehrfachbindung in C aktiviert und das Nucleophil kann nun rasch angreifen. Interessanterweise ist die Reaktionsgeschwindigkeit dabei viel höher als bei verwandten Katalysatoren wie Platin(II)-Katalysatoren. Durch aufwendige Rechnungen kann man heute den Reaktivitätsunter schied sogar erklären [6], die Molekülorbitale der Metall-Substrat-Komplexe passen im Fall des Goldes viel besser für den Angriff des Nucleophils als im Fall des Platins und anderer Metalle. Die Zwischenstufen sind Alkyl- oder Vinylgoldverbindungen (D). Vermeidet man die Anwesenheit von starken Elektrophilen, können diese sogar isoliert und durch Röntgen-Kristallstrukturanalysen charakterisiert werden. Mit Elektrophilen hingegen erfolgt eine rasche Reaktion, neben Protonen (meist aus dem Nucleophil) können hier Halogene [7] und sogar Palladium(II)- Zwischenstufen [8] für Kreuzkupplungen eingesetzt werden. Goldcarbenoide als Zwischenstufen – komplexe Syntheseplanung Alternativ können jedoch auch völlig andersartige Reaktionswege von den Vinylgold-Zwischenstufen beschritten werden. Wenn elektrophile Gruppen im Molekül so angeordnet sind, dass der Angriff am anderen Ende der Vinylgruppe in H erfolgt, erhält man ein Gold-carbenoid I. Von diesen sind verschiedenste Reaktionen bekannt, sie können mit einem weiteren Nukleophil reagieren, sie können cyclopropanieren oder sogar, wie unten gezeigt, zu interessanten Vinylcarbenoiden J und diese dann sogar mit Carbonylgruppen, also sehr schwachen Nucleophilen, reagieren. In einer komplexen Reaktionskaskade entsteht anschließend über eine Valenztautomerisierung und eine regioselektive Ringöffnung ein Phenol K [10]. Für die Planung einer Synthese muss der Chemiker – vom Zielmolekül ausgehend – diese Sequenz „rückwärts denken“, was hier zu einmaligen retrosynthetischen Schnitten führt, die den Regeln der „klassischen“ Retrosynthese widersprechen. Damit bietet die Goldkatalyse für die Herstellung von Molekülen völlig neue und einzigartige Möglichkeiten. Deren effiziente Nutzung fordert vom Anwender aber die Beherrschung konzeptionell sehr schwieriger Planungsregeln. Gold-Vinylidenzwischenstufen reagieren sogar mit nicht-aktivierten C-H-Bindungen Neben weiteren interessanten Konzepten wie oxidative C-C-Bindungsknüpfungen [11] und der oxidativen Generierung von alpha-Keto-Carbenoiden als reaktive Intermediate [12], hat nun eine weitere Familie spektakulärer Reaktionen auf sich aufmerksam gemacht. In Substraten vom Typ L sind zwei der Katalysatormoleküle LAu+ für den neuen Reaktionsmodus notwendig, das erste wird über eine sigma-Bindung als Goldacetylid gebunden, das zweite aktiviert dann das pi-System der anderen Dreifachbindung (M). Über diesen „Dual Activation“ genannten Reaktionsweg bildet sich dann ein Gold(I)-Vinylidenkomplex N. Studiert man die Struktur dieses Intermediats, zeigen Berechnungen einen stark elektrophilen Charakter am Carben-Kohlenstoffatom, hier ist ein großer Orbitalkoeffizient des niedrigsten unbesetzten Molekülorbitals zu beobachten. Damit ist dieses Intermediat nicht nur in der Lage, das pi-System aromatischer Ringe anzugreifen und so letztendlich in intermolekularen Reaktionen selektiv beta-substituierte Naphtaline Q oder in intramolekularen Reaktionen sonst nur schwierig zugängliche Dibenzopentalene P zu erzeugen. Darüber hinaus gelingt in spektakulärer Weise sogar die Reaktion mit nicht aktivierten C-H-Bindungen, Benzofulvene O können erhalten werden [13]. Solche selektive Reaktionen mit Alkylgruppen stellen gewissermaßen die Königsdisziplin der Organometall-Katalyse dar. Es bleibt spannend Nach einem zaghaften Beginn und einer Phase des exponentiellen Wachstums des Gebietes homogene Goldkatalyse findet sich heute kaum noch eine Ausgabe der entsprechenden Forschungsjournale ohne eine Publikation aus diesem Bereich. Dasselbe trifft auf Vorträge und Poster auf den passenden Fachkonferenzen zu. Und nach wie vor gehen wichtige neue Impulse für das Gebiet auf Gold zurück. Es scheint sich abzuzeichnen, dass Goldkatalysatoren auch in den nächsten Jahren Schrittmacher der Katalyseforschung darstellen werden. Literatur
[1] Bond, G.C. et al. (1973) Chem. Commun. 444-445. Foto: © Prof. Dr. A. Stephen K. Hashmi |
L&M 4 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |