|
Bio&Biotech
 >
Werkzeuge zur Steuerung von Leukozyten
>
Werkzeuge zur Steuerung von Leukozyten
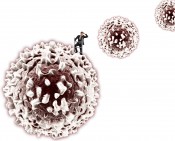
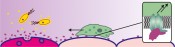
Werkzeuge zur Steuerung von LeukozytenMolekulare ManipulationLeukozyten, manchem besser als weiße Blutkörperchen bekannt, übernehmen wichtige Funktionen im menschlichen Immunsystem: Sie überwachen den Körper, spüren unerwünschte Eindringlinge auf und sammeln sich auf ein Entzündungssignal hin am Infektionsherd. Dort schütten sie einen Cocktail aus Enzymen und reaktiven Sauerstoffspezies aus, um Bakterien oder Parasiten zu bekämpfen, und helfen anschließend beim Aufräumen, indem sie abgetötete Mikroorganismen phagozytieren, also in sich aufnehmen und verdauen. Solche zellulären Rettungseinsätze müssen wohlkoordiniert sein, damit das umliegende Gewebe nicht geschädigt wird und die Entzündungsreaktion nach Beseitigung ihrer Ursache wieder aufgelöst wird. Fehlsteuerungen führen zu Überreaktionen oder chronischen Entzündungen wie rheumatoider Arthritis, asthmatischen Erkrankungen oder chronisch entzündlichen Darmerkrankungen. Es ist bekannt, dass die Schwere solcher Krankheiten mit der Zahl der einwandernden Immunzellen zusammenhängt und dass diese Einwanderung durch kleine Signalproteine, die Chemokine, gesteuert wird. Diese werden von Zellen am Entzündungsherd ausgeschüttet und breiten sich im Gewebe aus. Sie binden an spezifische Rezeptoren auf den Leukozyten und bewirken damit deren Wanderung in Richtung steigender Chemokinkonzentration, also hin zum Entzündungsort (Abb. 1).
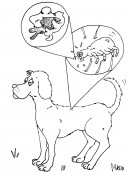
Abb. 1 Gereizte Zellen (hier: durch eine bakterielle Infektion, gelb) schütten Chemokine (violett) aus, die sich im Gewebe verteilen, von den Rezeptoren auf der Oberfläche der Leukozyten (grün) erkannt werden und die Migration dieser Zellen zum Entzündungsort auslösen. Parasiten umgehen Immunantwort Eine Strategie, um bei chronisch entzündlichen Erkrankungen für Linderung zu sorgen, ist daher die Inhibition der Chemokin-Rezeptor-Wechselwirkung. In der Natur haben Parasiten bereits Wege gefunden, die Immunantwort ihrer Wirtsorganismen zu umgehen. Beispielsweise produzieren Zecken in ihren Speicheldrüsen chemokinbindende Proteine, so genannte Evasine, die durch Bindung an Chemokine die Rekrutierung von Leukozyten an der Bissstelle verhindern. Damit bleiben auch die typischen Symptome eines Insektenbisses wie Anschwellen, Rötung und Juckreiz aus, sodass die Zecke ungestört auf ihrem Wirt verweilen kann (Abb. 2).
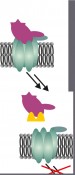
Abb. 2 Die braune Hundezecke (Rhipicephalus sanguineus) produziert in ihren Speicheldrüsen chemokinbindende Proteine, so genannte Evasine, die die Immunantwort unterdrücken und dafür sorgen, dass die Zecke ungestört auf ihrem Wirt verweilen kann. Bindungspartner entwerfen In unserer Arbeitsgruppe suchen wir nach Inhibitoren für die inflammatorischen Chemokine Interleukin-8 (CXCL8), das insbesondere die Wanderung neutrophiler Granulozyten steuert, und Eotaxin (CCL11), das eosinophile Granulozyten anspricht. Die Struktur der beiden Chemokine ist seit Langem bekannt und bietet Anhaltspunkte zum Design von Bindungspartnern. So ist bekannt, dass Interleukin-8 an zwei Stellen des Rezeptors binden muss, um diesen zu aktivieren: am N-Terminus, der für die Spezifität verantwortlich ist, und zwischen zwei extrazellulären Schleifen, die für die hohe Affinität des Rezeptors verantwortlich sind. Daher haben wir ein Peptid entworfen, das Aminosäuresequenzen aus den extrazellulären Schleifen des Rezeptors enthält. Es bindet etwa zehnmal so stark an Interleukin-8 wie ein literaturbekanntes Peptid aus der N-terminalen Rezeptorsequenz. Es inhibiert auch die Wanderung von Neutrophilen, die mit Interleukin-8 stimuliert wurden (Abb. 3).
Abb. 3 Peptide, abgeleitet aus der Bindungsstelle des Rezeptors, binden an Chemokine und verhindern deren Wechselwirkung mit dem Rezeptor und damit die Rezeptoraktivierung. Bindungsfreudige Peptoide Zwar lassen sich Peptide leicht aus den Strukturen von Rezeptoren ableiten, sie werden im Körper jedoch schnell abgebaut und sind daher nicht lange wirksam. Einen Ausweg bieten Peptoide, eine Klasse von Peptidanaloga, die nicht von Proteasen erkannt werden, jenen Enyzmen, die im Körper für den Abbau von Peptiden sorgen. Peptoide können mit den gleichen Methoden synthetisiert werden wie die Peptide. Bei der Festphasensynthese werden die Peptid- oder Peptoidbausteine nacheinander an funktionalisierte Kunststoffkügelchen, das Syntheseharz, gebunden, sodass eine definierte Abfolge von Bausteinen entsteht. Auf diese Weise lassen sich kombinatorische Bibliotheken erstellen, in denen jede mögliche Kombination aus einer vorgegebenen Auswahl an Bausteinen enthalten ist. Solche Sammlungen, die über 100.000 Verbindungen enthalten können, werden in unserer Gruppe nach möglichen Bindungspartnern für Chemokine durchmustert. Um die sprichwörtliche Nadel im Heuhaufen zu finden, werden Chemokine außerhalb der Rezeptorbindungsstelle mit einem roten Fluoreszenzfarbstoff markiert und auf die Partikel mit den synthetischen Peptoidsequenzen gegeben. Auf Partikeln mit Bindungspartnern reichert sich das Chemokin an und kann aufgrund seiner roten Fluoreszenz unter dem Mikroskop erkannt werden. Die Sequenz der partikelgebundenen Peptoide kann über ein massenspektrometrisches Verfahren identifiziert werden. So ist es möglich, die Peptoide mit Bindungsvermögen an ein Chemokin nachzusynthetisieren, um sie in weiteren Experimenten näher zu untersuchen. Muster im Mikrometermaßstab Für die oben geschilderten Verfahren wurden menschliche Chemokine und Varianten dieser Proteine in Bakterien hergestellt und weiter modifiziert. Mit diesen modifizierten Chemokinen lassen sich auch ganz andere Versuche durchführen: Man kann mit ihnen Muster auf Oberflächen herstellen, um die Migration von Neutrophilen zu steuern. Dabei stellt sich die Frage, welche Muster von Chemokinen von den Zellen als Gradient wahrgenommen werden und sie zur Wanderung veranlassen. Auch muss geklärt werden, inwiefern die Orientierung der Proteine auf der Oberfläche eine Rolle spielt, also ob ein stärkerer Effekt erzielt wird, wenn die Rezeptorbindungsstelle aller Proteine gezielt von der Oberfläche weg zeigen muss oder ob eine statistische Orientierung der einzelnen Moleküle ausreicht. Dazu werden künstlich hergestellte Chemokine so modifiziert, dass sie über eine bestimmte funktionelle Gruppe an der passend modifizierten Oberfläche verankert werden können (Abb. 4).
Abb. 4 Linienmuster, die eine ansteigende Oberflächenbedeckung mit Chemokinen vorgeben, können von Leukozyten als Gradienten erkannt werden und deren Bewegungsrichtung steuern – wenn die Auflösung des Musters fein genug ist, um vom Leukozyten erkannt zu werden. Muster von funktionalisierten Bereichen lassen sich mithilfe des Mikrokontaktstempelns erstellen. Bis zu einem Mikrometer dünne Linien oder Punkte lassen sich damit darstellen. Für die nur 8 –10 Mikrometer kleinen Leukozyten sind jedoch auch diese Muster relativ grob. Bessere Effekte erzielt man daher, wenn man anstelle der Schwarz-Weiß-Muster (Protein?/?kein Protein) Graustufenmuster erzeugen kann, in denen die Menge des Proteins im Mikrometermaßstab variiert. Während man lineare Gradienten durch Diffusion des Proteins in einen Stempel erreichen kann, sind kompliziertere Muster durch Lithografie im Zusammenspiel mit fotochemischen Verfahren zugänglich. Voraussetzung ist, dass die Menge des an die Oberfläche gebundenen Proteins mit der Dosis des eingestrahlten Lichts variiert werden kann. Durch Schreiben mit einem Laser oder Belichten durch eine Graustufenmaske können dann Muster mit unterschiedlichen Proteinbeladungen erzeugt werden. In einer Kooperation mit dem Institut für Mikrostrukturtechnik am KIT verwenden wir computergesteuerte Mikrospiegelarrays – die gleiche Technik, die in jedem Beamer für die Bilderzeugung zuständig ist – um Graustufenbilder im Bitmap-Format im Mikrometermaßstab auf Oberflächen zu projizieren und dementsprechend kleine Moleküle zu fixieren, an die sich passend modifizierte Proteine binden lassen. Potenziale für die Diagnostik Die Anwendungsmöglichkeiten für solche Proteinmuster sind schier unbegrenzt. Selbst Muster mit mehreren Proteinen sind denkbar. In unseren aktuellen Versuchen geht es darum herauszufinden, welche räumlichen und chemischen Hinweise Leukozyten zum Wandern brauchen. Solche Proteinmuster könnten jedoch später Anwendung in diagnostischen Chips finden, um die Aktivität verschiedener Leukozytenarten zu bestimmen und damit die Aktivierung des Immunsystems zu bestimmen oder festzulegen, welcher Chemokininhibitor in welcher Dosis verabreicht werden muss. Foto: © alphaspirit - Fotolia.com, petersimoncik - istockphoto.com |
L&M 5 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |